
聽(tīng)起來(lái)這(zhè)麽神奇的(de)NK細胞怎麽工作呢(ne)?
在巡邏時(shí),NK細胞會不斷接觸其他(tā)細胞,然後NK細胞會根據細胞表面的(de)激活性受體和(hé)抑制性受體的(de)信号平衡來(lái)決定是否殺死這(zhè)些細胞。抑制性受體(Inhibitory receptors)對(duì)NK細胞的(de)殺傷力起檢查作用(yòng)。
大(dà)多(duō)數正常健康細胞都會表達MHC I受體,這(zhè)會把這(zhè)些細胞标記爲“自己人(rén)"。NK細胞表面的(de)抑制性受體能識别同源的(de)MHC I,所以一旦識别到,就會 "關閉 "NK細胞,阻止其殺死正常細胞。
癌細胞和(hé)被感染的(de)細胞往往失去其MHC I,使它們可(kě)以被NK細胞判斷并且采取行動。一旦判定細胞不是“自己人(rén)”,NK細胞就會通(tōng)過細胞毒性突觸釋放含有穿孔蛋白和(hé)顆粒酶的(de)細胞毒顆粒,從而導緻目标細胞的(de)裂解。
被激活後,NK細胞分(fēn)泌細胞因子(如IFNγ、TNF)和(hé)趨化(huà)因子(如MIP1α),細胞因子會作用(yòng)于其他(tā)包括巨噬細胞和(hé)樹突狀細胞在内的(de)免疫細胞,調節其他(tā)細胞的(de)功能和(hé)販運,促進腫瘤微環境的(de)炎症。這(zhè)樣的(de)特點使NK細胞能夠獨特地規避涉及MHC-I減少的(de)免疫規避機制,一些對(duì)免疫檢查點抑制劑有抵抗力的(de)腫瘤也(yě)能被NK細胞療法治療。
這(zhè)給了(le)細胞治療領域的(de)專家們一個(gè)令人(rén)激動的(de)想法,即基于NK細胞的(de)免疫療法代表了(le)一種有希望的(de)補充性先天免疫療法,用(yòng)于治療對(duì)基于T細胞的(de)免疫療法有抵抗力的(de)晚期黑(hēi)色素瘤患者。
黑(hēi)色素瘤是一種侵襲性癌症,由于其複發的(de)高(gāo)風險和(hé)快(kuài)速發展的(de)過程,仍然是一個(gè)極大(dà)的(de)臨床挑戰,已成爲近幾年發病率增長(cháng)最快(kuài)的(de)惡性腫瘤之一。靶向治療和(hé)免疫治療方法已經徹底改變了(le)晚期黑(hēi)色素瘤的(de)治療,特别是針對(duì)CTLA-4和(hé)PD-1的(de)免疫檢查點阻斷抗體的(de)引入,大(dà)大(dà)改善了(le)晚期或轉移性黑(hēi)色素瘤患者的(de)存活率。
然而,盡管取得(de)了(le)這(zhè)些進展,半數以上的(de)患者對(duì)檢查點阻斷療法的(de)反應并不盡如人(rén)意。此外,即使是那些對(duì)檢查點阻斷有反應的(de)患者中,大(dà)約仍有50%的(de)患者會複發,這(zhè)樣的(de)現狀表明(míng),目前探索出新的(de)替代性免疫療法仍是一種迫切的(de)需求。
聖路易斯華盛頓大(dà)學醫學院癌症研究所的(de)研究者們對(duì)于使用(yòng)NK細胞治療實體瘤的(de)可(kě)能性有了(le)大(dà)膽的(de)想法,并通(tōng)過實驗證明(míng)了(le)他(tā)們的(de)假設:記憶樣NK細胞确實對(duì)黑(hēi)色素瘤反應很好,它可(kě)以作爲晚期黑(hēi)色素瘤治療的(de)策略之一。

研究論文
在他(tā)們的(de)研究中,首先使用(yòng)質譜儀來(lái)評估血液中的(de)NK細胞,實驗者們意識到,在黑(hēi)色素瘤患者中,患者進入轉移性黑(hēi)色素瘤組織的(de)NK細胞表現出降低的(de)細胞毒性潛力,具體表現爲粒酶B(GzmB)和(hé)穿孔蛋白的(de)表達減少。實驗者對(duì)11名晚期黑(hēi)色素瘤患者和(hé)15名HD患者的(de)血液NK細胞進行了(le)表型比較分(fēn)析,結果表明(míng)晚期黑(hēi)色素瘤患者的(de)血液NK細胞的(de)激活受體表達和(hé)細胞毒性潛力降低,也(yě)就是說患者自身的(de)NK細胞無法有效對(duì)癌細胞進行攻擊。
這(zhè)種缺陷可(kě)以通(tōng)過采用(yòng)NK細胞療法來(lái)解決——采取增強NK細胞抗黑(hēi)色素瘤活性的(de)方法,獲得(de)有效的(de)自體反應。
在該實驗中,研究者著(zhe)重研究了(le)記憶樣(ML)NK細胞對(duì)于黑(hēi)色素瘤的(de)反應。細胞因子誘導的(de)記憶樣(ML)分(fēn)化(huà)克服了(le)NK細胞治療領域的(de)許多(duō)障礙,當ML NK細胞再次遇到與之前相同的(de)抗原時(shí),能夠産生強而優于先前的(de)應答(dá),或炎症細胞因子的(de)環境産生記憶,再次相同炎症環境就産生更強烈的(de)殺傷反應,導緻針對(duì)癌症目标的(de)更強大(dà)的(de)細胞毒性和(hé)增強的(de)細胞因子産生。
爲了(le)解ML NK細胞反應對(duì)實體瘤的(de)活性,實驗者評估了(le)ML NK細胞響應和(hé)殺死黑(hēi)色素瘤細胞的(de)能力。NK細胞被提取,分(fēn)化(huà),然後使用(yòng)人(rén)類黑(hēi)色素瘤細胞系DM6和(hé)M14重新刺激。
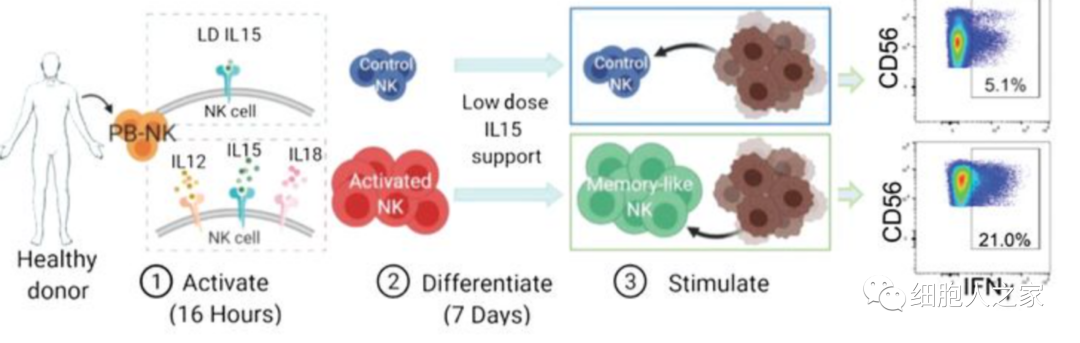
結果顯示,ML NK細胞展示了(le)卓越的(de)細胞因子反應,脫顆粒也(yě)很明(míng)顯,也(yě)表現出明(míng)顯的(de)增加和(hé)持續的(de)細胞毒性,從而獲得(de)消除黑(hēi)色素瘤靶細胞的(de)能力。這(zhè)些結果支持ML NK細胞在體外控制黑(hēi)色素瘤目标的(de)能力明(míng)顯增強。
接下(xià)來(lái)實驗者進一步推進了(le)研究,探索是否有可(kě)能從晚期黑(hēi)色素瘤患者中産生ML NK細胞,以及它們是否能夠控制自體黑(hēi)色素瘤目标。如圖所述,首先對(duì)晚期黑(hēi)色素瘤患者的(de)外周血單核細胞進行刺激,并将其NK細胞分(fēn)化(huà)爲ML NK細胞。從轉移病竈中産生的(de)自體原發性黑(hēi)色素瘤細胞被用(yòng)作功能試驗的(de)目标。
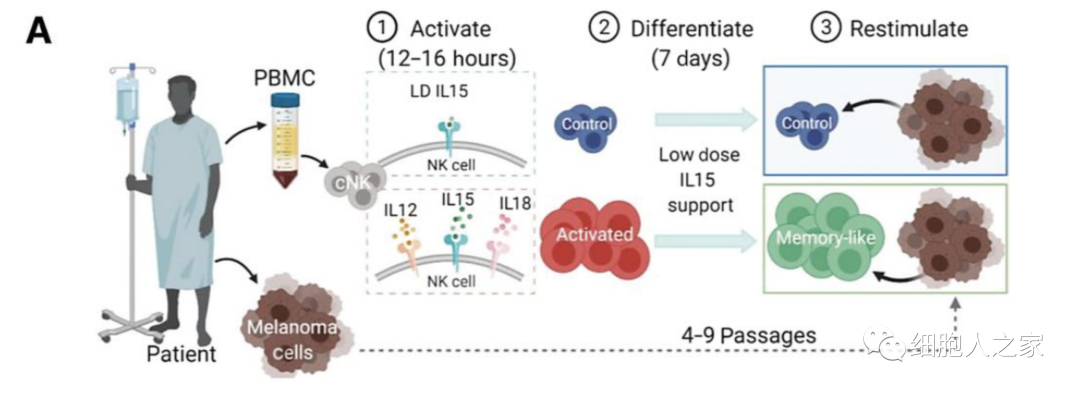
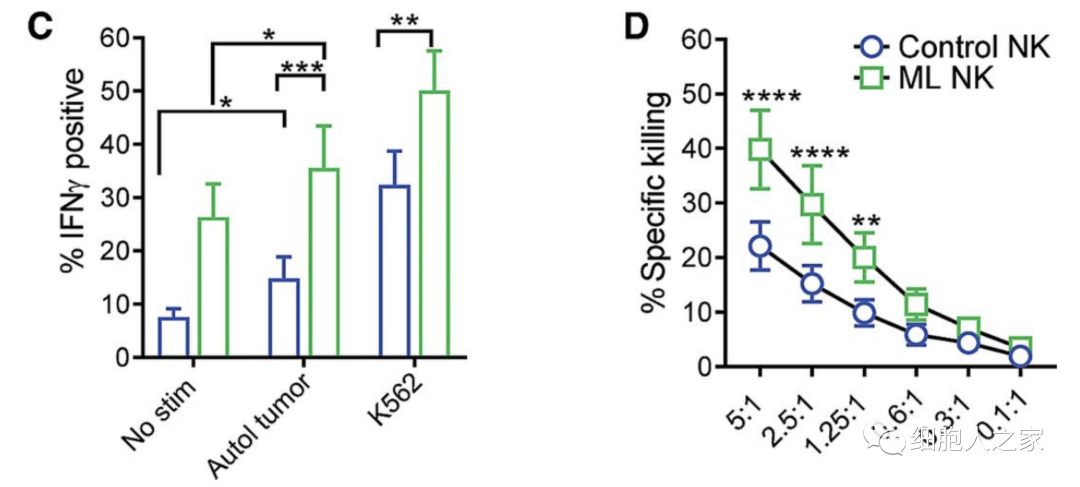
當用(yòng)自體黑(hēi)色素瘤靶點重新刺激時(shí),與對(duì)照(zhào)組的(de)普通(tōng)NK細胞相比,ML NK細胞表現出細胞因子IFNγ産量明(míng)顯增加,且來(lái)自晚期黑(hēi)色素瘤患者的(de)ML NK細胞對(duì)自體黑(hēi)色素瘤細胞的(de)特異性殺傷也(yě)有明(míng)顯增加。這(zhè)些數據表明(míng),從晚期黑(hēi)色素瘤患者分(fēn)化(huà)出來(lái)的(de)ML NK細胞表現出更強的(de)控制自體腫瘤的(de)能力。
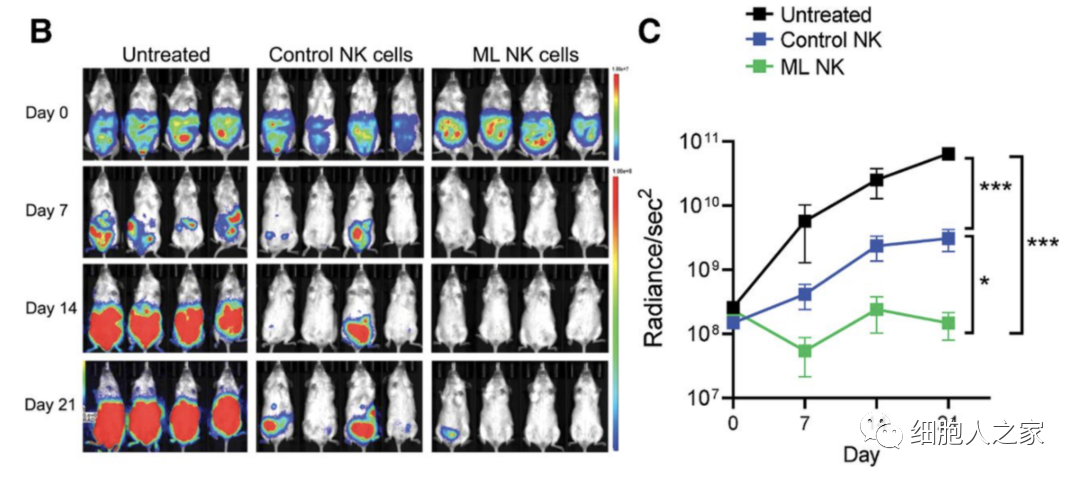
在實驗的(de)最後部分(fēn),使用(yòng)人(rén)類異種移植模型到免疫缺陷的(de)鼠體内,評估人(rén)類ML NK細胞控制黑(hēi)色素瘤目标的(de)能力。給小鼠注射1×105個(gè)DM6-RhoC-Luc細胞,1天後小鼠接受一次5×106個(gè)對(duì)照(zhào)NK細胞或ML NK細胞(腹腔注射)。每周通(tōng)過發光(guāng)成像監測黑(hēi)色素瘤的(de)負荷。
與未經處理(lǐ)的(de)小鼠相比,接受對(duì)照(zhào)NK細胞的(de)小鼠能夠顯著控制黑(hēi)色素瘤的(de)腫瘤負荷,且相比之下(xià),采用(yòng)單劑量ML NK細胞轉移的(de)小鼠在體内控制黑(hēi)色素瘤細胞的(de)能力明(míng)顯更強,腫瘤負荷在實驗期間得(de)到控制。許多(duō)小鼠的(de)腫瘤縮小到幾乎無法檢測到的(de)程度,且在大(dà)多(duō)數情況下(xià),ML NK細胞都阻止了(le)腫瘤的(de)複發。
無獨有偶,根據NK細胞在人(rén)體試驗的(de)結果顯示的(de)數據,同樣值得(de)期待。在今年4月(yuè)的(de)AACR會議(yì)上,Affimed公司公布了(le)其臍帶血源性自然殺傷細胞療法的(de)1/2期臨床試驗數據:在最高(gāo)劑量水(shuǐ)平治療的(de)24例CD30陽性淋巴瘤患者中,客觀緩解率(ORR)高(gāo)達100%,其中完全緩解率(CR)達到了(le)70.8%。

注:客觀緩解率(ORR)是指腫瘤體積縮小達到預先規定值,并能維持最低時(shí)限要求的(de)患者比例,ORR越高(gāo)說明(míng)使用(yòng)該治療方法達到腫瘤縮小的(de)患者越多(duō)。
綜上,越來(lái)越多(duō)的(de)數據表明(míng),NK細胞療法給我們指明(míng)了(le)一個(gè)新的(de)方向,是近年來(lái)是免疫療法中的(de)一個(gè)新突破。NK細胞的(de)活性、識别腫瘤細胞的(de)能力都代表著(zhe)這(zhè)一療法的(de)潛力,能夠通(tōng)過多(duō)種機制發揮抗腫瘤作用(yòng),讓腫瘤患者體内擁有更多(duō)的(de)NK細胞或者人(rén)爲增強NK細胞的(de)功能,抑制腫瘤生長(cháng),甚至更進一步,預防腫瘤。
細胞治療正在完全轉變人(rén)與疾病的(de)關系,指引我們走向一個(gè)更健康、更長(cháng)壽、活得(de)更自在的(de)未來(lái)。
來(lái)源 | 網絡
免責聲明(míng):我們尊重原創,也(yě)注重分(fēn)享。部分(fēn)内容來(lái)自互聯網,版權歸原作者所有,僅供學習(xí)參考之用(yòng),如有侵權請聯系本文作者删除。
End
----------THE END----------
免責聲明(míng):本文系轉載分(fēn)享,文章(zhāng)觀點、内容、圖片及版權歸原作者所有,如涉及侵權請聯系删除!