一、細胞治療行業概況
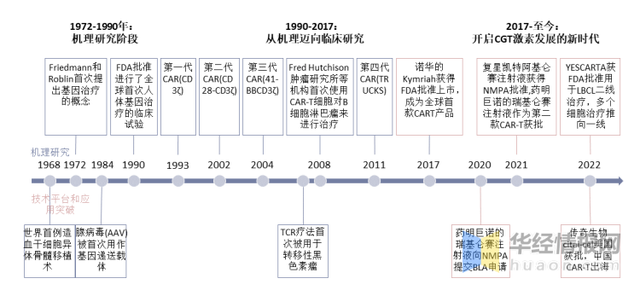
1、細胞治療發展曆程
CAR-T,即嵌合抗原受體T細胞免疫療法。通(tōng)過将識别腫瘤相關抗原在體外進行基因重組,通(tōng)過病毒侵染嵌合到患者T細胞,使患者T細胞表達腫瘤抗原受體,經過純化(huà)和(hé)大(dà)規模擴增後的(de)T細胞,也(yě)即CAR-T細胞。
1990s開始,科學家開始研發CAR-T,并且不斷改進CAR結構;2017年美(měi)國FDA批準全球首款CAR-T産品上市;2021年,中國NMPA批準兩款CAR-T上市;2022年2月(yuè),中國企研發的(de)CAR-T産品cital-cel成功在美(měi)國上市銷售。
細胞治療發展曆史
資料來(lái)源:公開資料整理(lǐ)
2、免疫細胞療法特點對(duì)比
目前T細胞、NK細胞(自然殺傷細胞)在免疫細胞治療中應用(yòng)較多(duō)。T細胞是目前應用(yòng)最成熟的(de)免疫細胞,具有特異性殺傷腫瘤的(de)作用(yòng)。腫瘤細胞具有逃避T細胞免疫識别的(de)機制,PD1抗體等免疫檢查點抑制劑類通(tōng)過打開T細胞識别腫瘤的(de)“開關”從而激活T細胞殺傷作用(yòng),而基于T細胞的(de)細胞療法則是将天然或強化(huà)過的(de)T細胞輸入進人(rén)體内殺傷腫瘤。
免疫細胞療法特點對(duì)比

資料來(lái)源:公開資料整理(lǐ)
二、CAR-T細胞治療産業鏈
細胞治療産業鏈以CAR-T爲例,上遊爲流式細胞儀等設備生産商和(hé)用(yòng)于T細胞分(fēn)選、轉染等步驟的(de)試劑,以及細胞因子等原、輔料。中、下(xià)遊分(fēn)别爲CAR-T研發和(hé)産品生産企業,其中許多(duō)研發企業也(yě)選擇自行制備慢(màn)病毒載體,生産CAR-T細胞。
CAR-T細胞治療産業鏈

資料來(lái)源:公開資料整理(lǐ)
三、全球CAR-T細胞治療行業市場(chǎng)現狀分(fēn)析
1、CAR-T細胞治療銷售額
據統計,2021年全球CAR-T産品銷售額合計已達17.1億美(měi)元,其中CD19産品合計15.5億美(měi)元,CD19CAR-T銷售額逐季增長(cháng)。吉利德的(de)Yescarta2021年銷售額7.0億美(měi)元,且2022Q2仍在同比增長(cháng)。此外,吉利德Tecartus及BMS Breyanzi處于銷售爬坡階段。
2017-2022年CD19CAR-T季度銷售額(百萬美(měi)元)
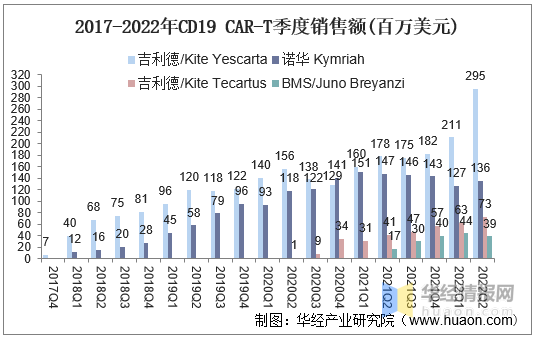
資料來(lái)源:公開資料整理(lǐ)
2021年全球BCMA産品合計1.6億美(měi)元,目前BCMA CAR-T處于爬坡初期。BMS Abecma2022Q2單季度銷售額8900萬美(měi)元,環比增長(cháng)33%。強生/傳奇Carvykti上市首個(gè)季度銷售2400萬美(měi)元,與Abecma上市首個(gè)季度一緻。
2021-2022年BCMACAR-T季度銷售額(百萬美(měi)元)
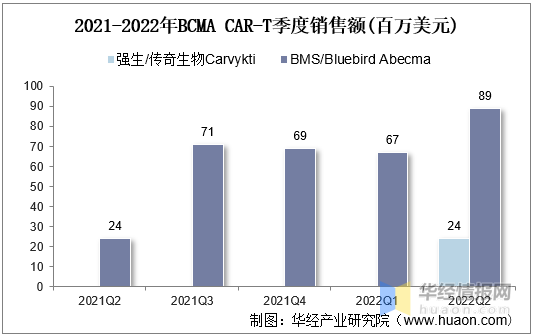
資料來(lái)源:公開資料整理(lǐ)
2、CAR-T生産成本
從Gene&Cell Therapy Insights對(duì)Kite的(de)Yescarta生産成本的(de)來(lái)看,每劑CAR-T生産成本爲58200美(měi)元,其中人(rén)工成本占比最高(gāo)爲71%,耗材成本爲18%,廠房(fáng)設備成本爲12%。
CAR-T生産成本拆分(fēn)(單位:%)
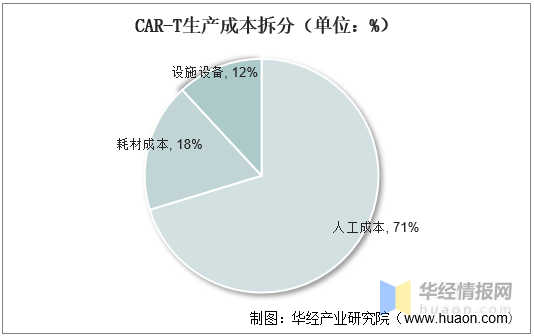
資料來(lái)源:CELL&GENE THERAPY INSIGHTS,華經産業研究院整理(lǐ)
四、中國CAR-T細胞治療行業市場(chǎng)現狀分(fēn)析
1、市場(chǎng)空間
國内市場(chǎng)方面,我國細胞治療市場(chǎng)空間将由2021年的(de)13億元增長(cháng)至2030年的(de)584億元,年均增速高(gāo)達53%。其中CAR-T細胞療法市場(chǎng)空間将由2021年的(de)3億元增長(cháng)至2030年的(de)288億元;其他(tā)細胞治療市場(chǎng)空間将由2021年的(de)10億元增長(cháng)至2030年的(de)297億元。
2021-2030年國内CAR-T細胞治療市場(chǎng)空間預測
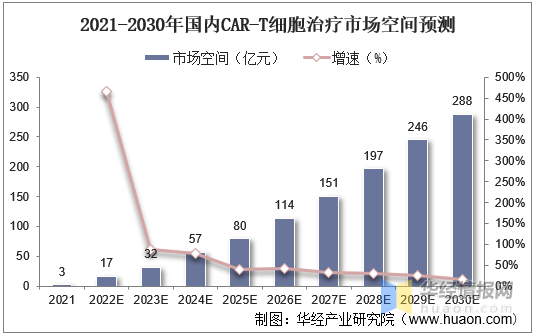
資料來(lái)源:公開資料整理(lǐ)
2、專利情況
随著(zhe)CAR-T細胞治療技術熱(rè)度上升,越來(lái)越多(duō)的(de)企業開始進入該領域,市場(chǎng)競争愈發激烈,專利布局作爲市場(chǎng)競争的(de)有力武器,各公司對(duì)CAR-T細胞治療技術專利布局更加重視,近年來(lái)CAR-T細胞治療技術專利申請呈現爆發式增長(cháng)。我國CAR-T細胞治療技術起步較晚,直到2011年才開始有相關專利申請,2015年後,随著(zhe)全球專利申請數量的(de)快(kuài)速攀升,我國CAR-T細胞治療領域專利申請也(yě)有較大(dà)程度的(de)增長(cháng),2016年後專利年申請量超過400件。
2011-2021年我國CAR-T細胞治療技術專利申請趨勢
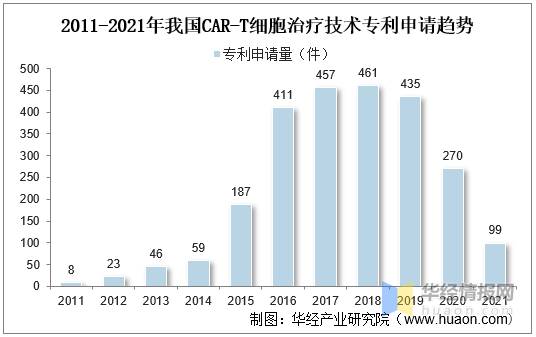
資料來(lái)源:知識産權出版社有限責任公司,華經産業研究院整理(lǐ)
從我國CAR-T細胞治療專利技術來(lái)源地分(fēn)布來(lái)看,上海市是我國CAR-T細胞治療技術發展最爲突出的(de)城(chéng)市,上海細胞治療集團、上海恒潤達生生物(wù)科技有限公司、上海邦耀生物(wù)科技有限公司、上海優卡迪生物(wù)醫藥科技有限公司、科濟生物(wù)醫藥(上海)有限公司、亘喜生物(wù)科技(上海)有限公司都在CAR-T細胞治療領域積極探索并實施專利布局策略。
上海市是我國CAR-T細胞治療技術發展最爲突出的(de)城(chéng)市,上海細胞治療集團、上海恒潤達生生物(wù)科技有限公司、上海邦耀生物(wù)科技有限公司、上海優卡迪生物(wù)醫藥科技有限公司、科濟生物(wù)醫藥(上海)有限公司、亘喜生物(wù)科技(上海)有限公司都在CAR-T細胞治療領域積極探索并實施專利布局策略。
國内CAR-T細胞治療專利技術來(lái)源地
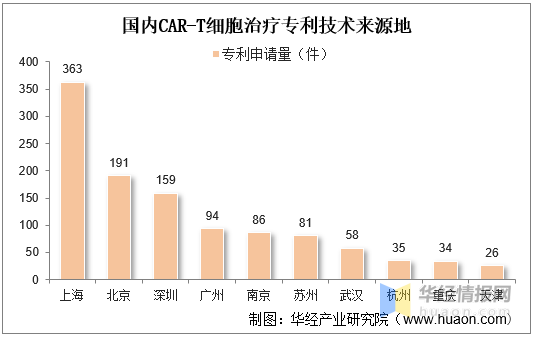
資料來(lái)源:知識産權出版社有限責任公司,華經産業研究院整理(lǐ)
在我國專利申請TOP30申請人(rén)中,有17位是我國本土申請人(rén),10位是美(měi)國申請人(rén),另外3位申請人(rén)分(fēn)别來(lái)自瑞士、法國和(hé)英國。CAR-T細胞治療領域中國專利申請人(rén)中,深圳賓德生物(wù)技術有限公司、賓夕法尼亞大(dà)學、百時(shí)美(měi)施貴寶專利申請數量位居前三位,是中國CAR-T細胞治療專利技術最具優勢的(de)創新主體,而諾華公司、上海細胞治療集團、美(měi)國衛生和(hé)人(rén)力服務部在中國也(yě)具有非常明(míng)顯的(de)CAR-T細胞治療專利優勢。
中國CAR-T細胞治療專利申請人(rén)Top30(件)
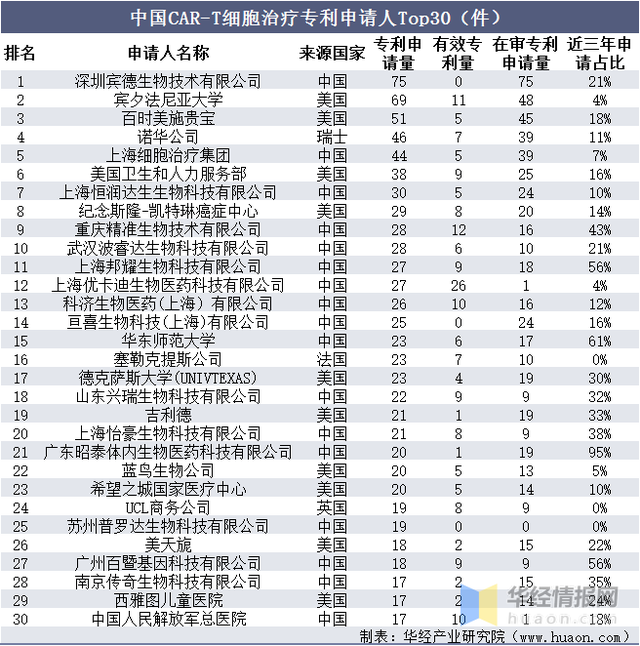
資料來(lái)源:知識産權出版社有限責任公司,華經産業研究院整理(lǐ)
五、CAR-T細胞治療行業競争格局分(fēn)析
1、現有CAR-T銷售現狀
2017年,諾華第一款CAR-T藥物(wù)上市,啓動細胞治療商業化(huà)的(de)大(dà)門,至今已有六款細胞治療藥物(wù)上市:①前四款都是選擇CD19爲治療靶點,後兩是BCMA;②目前治療領域集中在血液瘤,更多(duō)藥企在逐步開展實體瘤研發;③目前CAR-T均爲自體細胞療法,通(tōng)用(yòng)型産品仍在研發當中。國内企業進展迅速,複星凱特、藥明(míng)巨諾的(de)産品均在國内上市;傳奇生物(wù)額cital-cel成功在美(měi)國上市。
現有CAR-T療法售價及2021年銷售額
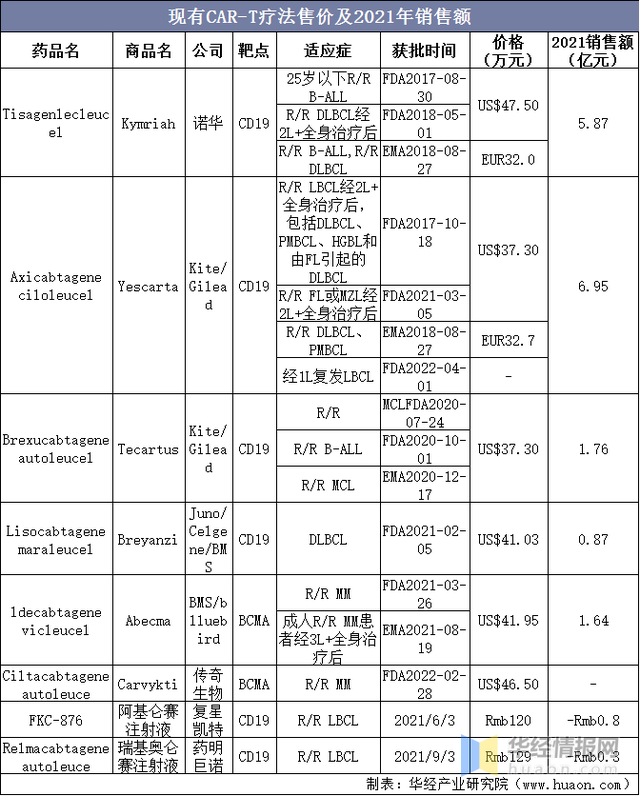
資料來(lái)源:FDA,各公司公告,華經産業研究院整理(lǐ)
2、國内研發現狀
國内已批準複星凱特、藥明(míng)巨諾等2款靶向于CD19的(de)CAR-T療法,而信達生物(wù)/馴鹿醫療的(de)BCMACAR-T療法正在申請上市,此外美(měi)國已批準傳奇生物(wù)開發的(de)BCMACAR-T。
中國企業CAR-T國内臨床研發管線數量(單位:款)
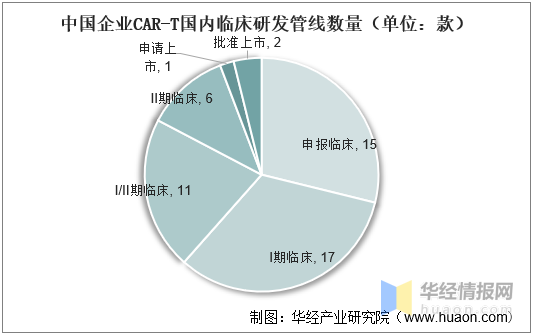
資料來(lái)源:公開資料整理(lǐ)
目前我國企業在國内開展的(de)CAR-T臨床管線主要集中于CD19與BCMA,也(yě)有一些公司在新靶點上做(zuò)出突破,如科濟藥業在CLDN18.2的(de)胃癌實體瘤中展現CAR-T療法的(de)初步療效。
中國企業CAR-T國内臨床研發管線靶點分(fēn)布
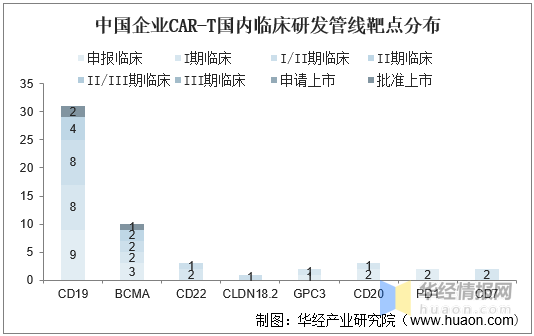
資料來(lái)源:公開資料整理(lǐ)
3、國内細胞治療CRO/CDMO主要公司
我國基因細胞治療CRO/CDMO公司快(kuài)速崛起。涉及上市公司主要有藥明(míng)康德、金斯瑞生物(wù)科技、和(hé)元生物(wù)、博騰股份,非上市公司主要有宜明(míng)細胞、派真生物(wù)、五加和(hé)、譜新細胞、阿思科力、源興基因等。
中國基因細胞治療CRO/CDMO主要公司
 /p>
/p>
資料來(lái)源:公開資料整理(lǐ)
六、CAR-T細胞治療展望
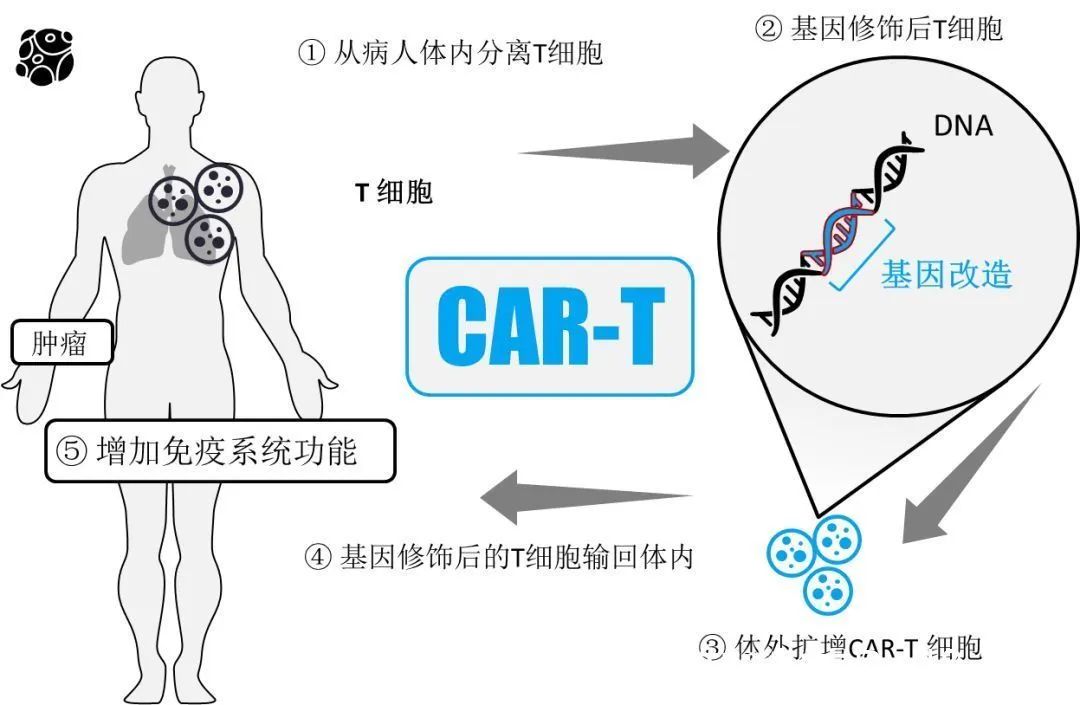
當前,CAR-T治療尚處于發展的(de)初級階段,還(hái)存在幾個(gè)重要難題亟待解決:CRS和(hé)ICANS等不良反應;腫瘤相關抗原逃逸導緻癌症複發(如CD19逃逸);在慢(màn)性白細胞白血病和(hé)非霍奇金淋巴瘤中需要提高(gāo)效應活力;在實體瘤中表現未達預期;通(tōng)用(yòng)型CAR-T還(hái)未真正走向臨床,前幾代的(de)CAR-T治療成本過于高(gāo)昂。
目前,全球共有5款CAR-T産品已經在美(měi)國獲批上市,但這(zhè)些産品價格在35萬~50萬美(měi)元,一般患者根本無法承擔。目前臨床應用(yòng)的(de)大(dà)多(duō)數CAR-T屬于第二代,而第三代、第四代CAR-T以及有望規模化(huà)生産以降低成本的(de)通(tōng)用(yòng)性CAR-T的(de)臨床應用(yòng)案例較少,未來(lái)降低CAR-T成本的(de)制備生産必定是CAR-T療法的(de)重要發步階段,尚無比較完善的(de)監管體系,也(yě)缺乏相關的(de)指導和(hé)參考,這(zhè)導緻不同單位生産出來(lái)的(de)CAR-T質量參差不齊,甚至同一家單位生産出來(lái)的(de)産品也(yě)存在較大(dà)的(de)差異性。
在臨床試驗方面,我國有超過20家機構正在進行CAR-T産品的(de)臨床申報,這(zhè)些還(hái)不包括在國家衛生健康委員(yuán)會備案直接進行細胞治療的(de)醫院以及在國外進行CAR-T産品申報的(de)企業。如果沒有完善的(de)醫保政策支持及相應的(de)政策指導,動辄數百萬元人(rén)民币的(de)治療費用(yòng)以及一系列不可(kě)控的(de)臨床治療風險終将會使腫瘤患者望而卻步。
來(lái)源:求實藥社
----------THE END----------
免責聲明(míng):本文系轉載分(fēn)享,文章(zhāng)觀點、内容、圖片及版權歸原作者所有,如涉及侵權請聯系删除!