今天注定會被載入人(rén)類抗擊阿爾茨海默病(AD)的(de)史冊。
美(měi)國時(shí)間6月(yuè)7日,FDA加速審批渤健生物(wù)單抗藥物(wù)Aducanumab上市,用(yòng)于治療AD【1】。
這(zhè)是自2003年以來(lái),FDA批準的(de)首款AD新藥,也(yě)是自阿爾茨海默病被命名100多(duō)年來(lái),首款獲批的(de)疾病修正類藥物(wù)。
至此,人(rén)類結束了(le)無法從根本上阻擋AD疾病進展的(de)滄桑曆史。

200多(duō)年前,當法國著名醫生,拿破侖私人(rén)醫生Philippe Pinel 和(hé)他(tā)的(de)得(de)意門生Jean Etienne Esquirol首次将老年性癡呆與其他(tā)癡呆分(fēn)開時(shí)【2】,人(rén)類對(duì)AD還(hái)知之甚少。
100多(duō)年前,當Alois Alzheimer 首次通(tōng)過解剖發現AD患者大(dà)腦(nǎo)内存在澱粉樣斑塊和(hé)神經原纖維纏結時(shí),人(rén)類對(duì)AD仍然知之甚少。
30多(duō)年前,首款AD藥物(wù)進入臨床試驗,在随後的(de)十餘年時(shí)間裏,FDA批準了(le)5款治療AD的(de)藥物(wù),但這(zhè)些藥無一例外都是症狀緩解類藥物(wù),對(duì)于AD疾病進展無能爲力。站在這(zhè)個(gè)曆史節點,人(rén)類對(duì)AD依舊(jiù)知之甚少。
30多(duō)年後的(de)今天,首款可(kě)以阻止AD進展的(de)疾病修正類藥物(wù)終于獲批上市。雖然AD的(de)迷局人(rén)類仍然沒有看清,但至少,我們站在了(le)一個(gè)新的(de)起點上。

Alois Alzheimer先生(圖片來(lái)源:維基百科)
200年間,AD從一個(gè)鮮爲人(rén)知的(de)疾病,成爲影(yǐng)響全球數千萬人(rén)的(de)迷失夢魇。據統計,2019年,全球癡呆症患者數量高(gāo)達5000萬,到了(le)2050年,這(zhè)一人(rén)數還(hái)将增至1.5億【3】。同時(shí)據估計,到2030年,AD導緻的(de)經濟負擔将達到25億美(měi)元,而到了(le)2050年,這(zhè)一數字将達到91億美(měi)元【4】。
與此同時(shí),百餘款潛在新藥葬身于AD藥物(wù)研發的(de)天坑,從1998年到2017年,就有146款藥物(wù)墜入天坑【5】。但是面對(duì)迷失的(de)深淵,人(rén)類不會退縮,因爲我們沒有退路。
Aducanumab登場(chǎng)時(shí)一鳴驚人(rén)。
2016年9月(yuè)1日,享譽世界的(de)頂級期刊《自然》在封面出現了(le)兩個(gè)醒目的(de)大(dà)寫單詞:TARGETING AMYLOID,似乎在宣告一個(gè)振奮人(rén)心的(de)新時(shí)代的(de)到來(lái)。

圖片來(lái)源:參考文獻【6】
當期的(de)封面文章(zhāng)展示了(le)一項激動人(rén)心的(de)結果:靶向β澱粉樣蛋白(Aβ)的(de)全人(rén)源單抗藥物(wù)Aducanumab在Ib期的(de)PRIME研究中顯示,可(kě)以有效降低患者大(dà)腦(nǎo)中的(de)澱粉樣斑塊,且呈現劑量和(hé)時(shí)間依賴性。同時(shí),Aducanumab在治療1年後可(kě)延緩認知衰退,療效呈劑量依賴性【6】。
這(zhè)是有史以來(lái)第一款能夠減少AD患者大(dà)腦(nǎo)中Aβ,同時(shí)又可(kě)以延緩認知衰退的(de)藥物(wù)。經曆了(le)漫長(cháng)至暗時(shí)刻的(de)澱粉樣蛋白假說終于出現了(le)罕見的(de)光(guāng)明(míng)。
與此同時(shí),Aducanumab的(de)兩項三期研究正在緊羅密布地開展。ENGAGE和(hé)EMERGE兩項研究招募了(le)2700例早期AD患者,臨床主要終點爲第18個(gè)月(yuè)時(shí)的(de)CDR-SB【7~8】。

圖片來(lái)源:upsplash
但事情并非一帆風順。
2018年12月(yuè),入組患者完成了(le)18個(gè)月(yuè)治療,随後基于無效性分(fēn)析結果,兩項三期試驗于2019年3月(yuè)21日宣布終止。久違的(de)希望似乎又要破滅了(le)。
然而就在試驗終止後的(de)7個(gè)月(yuè),2019年10月(yuè),渤健宣布,結合更大(dà)數據集的(de)重新分(fēn)析推翻了(le)此前的(de)無效性分(fēn)析結果。
針對(duì)更大(dà)數據集的(de)分(fēn)析發現,EMERGE研究的(de)高(gāo)劑量組達到了(le)主要終點,即在第78周,Aducanumab高(gāo)劑量組的(de)CDR-SB評分(fēn)較安慰劑顯著降低。
EMERGE研究的(de)高(gāo)劑量組還(hái)顯示,患者在第78周時(shí)較基線可(kě)延緩臨床進展;患者在認知方面(如記憶、定向力和(hé)語言)具有顯著獲益。患者在日常生活能力方面,如管理(lǐ)個(gè)人(rén)财務、做(zuò)家務(打掃,購(gòu)物(wù),洗衣服)和(hé)獨立出門旅行方面也(yě)具有獲益。
不久之後,渤健向FDA提交了(le)Aducanumab的(de)上市申請。2020年8月(yuè)7日,美(měi)國FDA宣布Aducanumab生物(wù)制劑許可(kě)申請(BLA)獲得(de)優先審查。此後,經過10個(gè)月(yuè)的(de)焦灼之後,FDA終于在今天宣布Aducanumab獲得(de)上市批準。

圖片來(lái)源:維基百科
100多(duō)年前,Alois Alzheimer 通(tōng)過顯微鏡看到AD患者大(dà)腦(nǎo)中兩種異常蛋白沉積:細胞外的(de)β澱粉樣蛋白斑塊以及細胞内的(de)神經原纖維纏結。正是這(zhè)曆史性的(de)一瞥開啓了(le)AD疾病分(fēn)子研究的(de)序幕。
1984年,美(měi)國加州大(dà)學聖地亞哥(gē)分(fēn)校的(de)病理(lǐ)學家George Glenner 分(fēn)離出了(le)β澱粉樣蛋白。此後,George Glenner 和(hé)同事Caine Wong 的(de)研究提示,β澱粉樣蛋白可(kě)能是由一種更大(dà)的(de)蛋白被切割而産生的(de)【9】。
3年後他(tā)們的(de)預測就得(de)到了(le)證實。1987年,德國科隆大(dà)學的(de)科學家在頂級期刊《自然》上發表文章(zhāng),宣布他(tā)們在21号染色體上發現了(le)一種與遺傳性阿爾茨海默病相關的(de)基因,即澱粉樣蛋白前體蛋白(APP)基因【10】。此時(shí),AD發病機制的(de)澱粉樣蛋白假說開始萌芽,但還(hái)沒有受到廣泛的(de)認可(kě)。
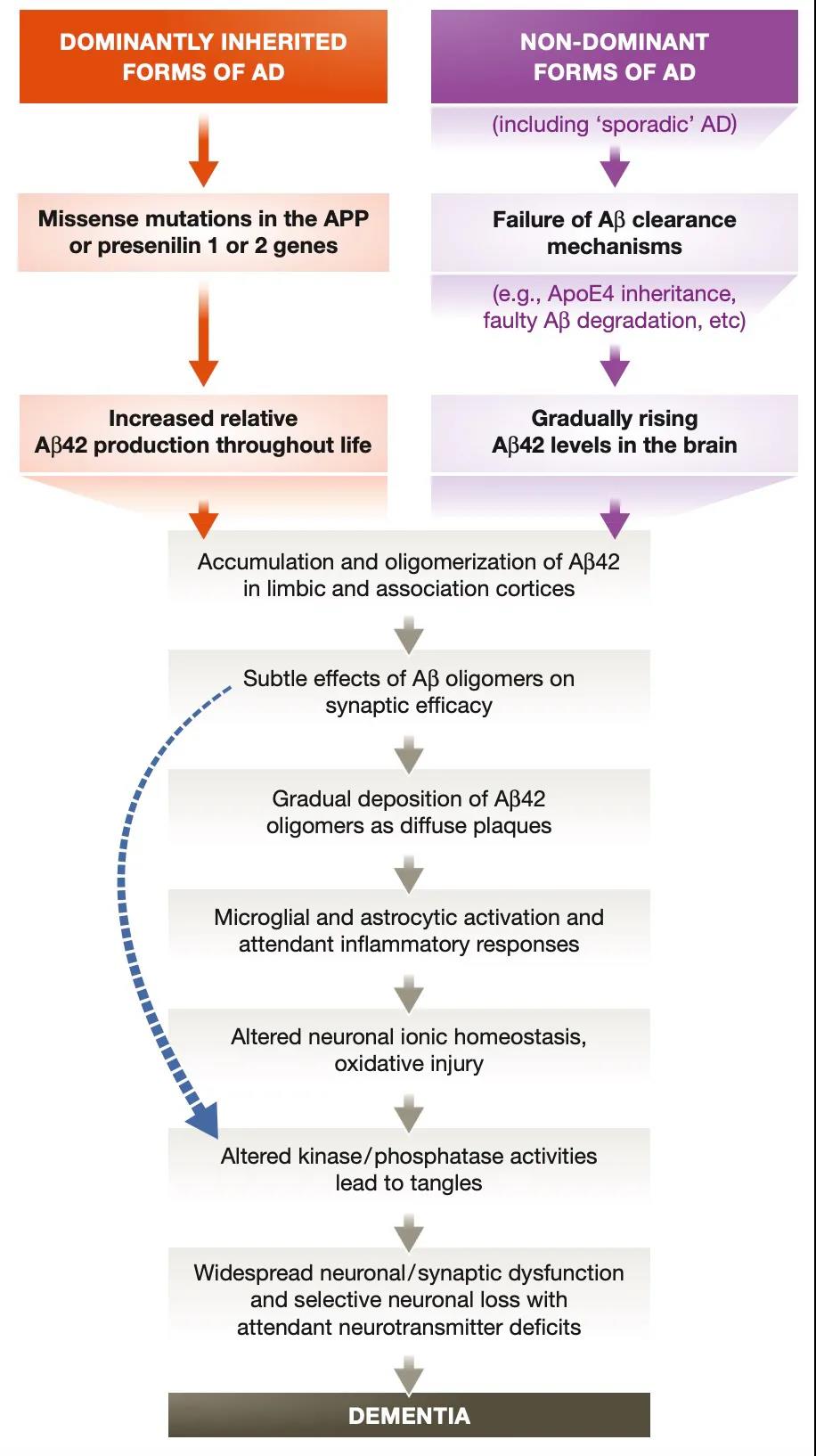
澱粉樣蛋白假說(圖片來(lái)源:參考文獻【11】)
現在我們知道,β澱粉樣蛋白是由澱粉樣蛋白前體蛋白(APP)依序水(shuǐ)解産生的(de)。APP是一種跨膜蛋白,在許多(duō)人(rén)體組織中都有表達,尤其是在神經元突觸中大(dà)量表達。
人(rén)類的(de)APP可(kě)以通(tōng)過兩種不同的(de)途徑加工,分(fēn)别爲澱粉樣蛋白途徑和(hé)非澱粉樣蛋白途徑。在APP的(de)澱粉樣蛋白加工過程中,β-分(fēn)泌酶首先将APP切割成膜連接的(de)C端片段β(CTFβ或C99)和(hé)N端sAPPβ【12】。
随後,CTFβ被γ-分(fēn)泌酶切割成結構域AICD和(hé)一系列氨基酸片段。這(zhè)些氨基酸片段會被進一步水(shuǐ)解加工成β澱粉樣蛋白最終形式:含40個(gè)氨基酸的(de)Aβ40和(hé)含42個(gè)氨基酸的(de)Aβ42【13~14】。
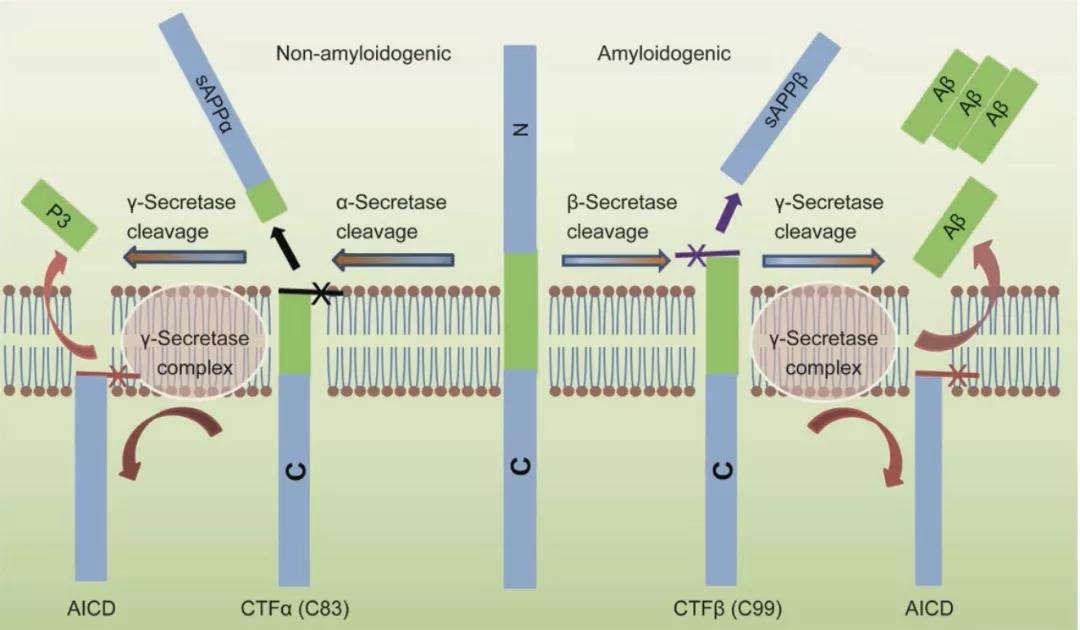
APP兩種不同的(de)加工路徑(圖片來(lái)源:參考文獻【15】)
奠定澱粉樣蛋白假說基石的(de)證據來(lái)自于對(duì)家族性AD的(de)深入研究。1991年,由Hardy領銜的(de)研究團隊發現了(le)第一個(gè)可(kě)以導緻家族性AD的(de)APP基因突變【16】。
5年後,其他(tā)兩種導緻家族性AD的(de)基因突變也(yě)被發現:編碼γ分(fēn)泌酶複合體亞基的(de)PSEN1 和(hé)PSEN2錯義突變,會導緻APP水(shuǐ)解過程中産生更多(duō)Aβ42【17】。此外,有關21三體綜合征(唐氏綜合征)和(hé)ApoE4等位基因的(de)研究也(yě)都強有力地支持澱粉樣蛋白假說。
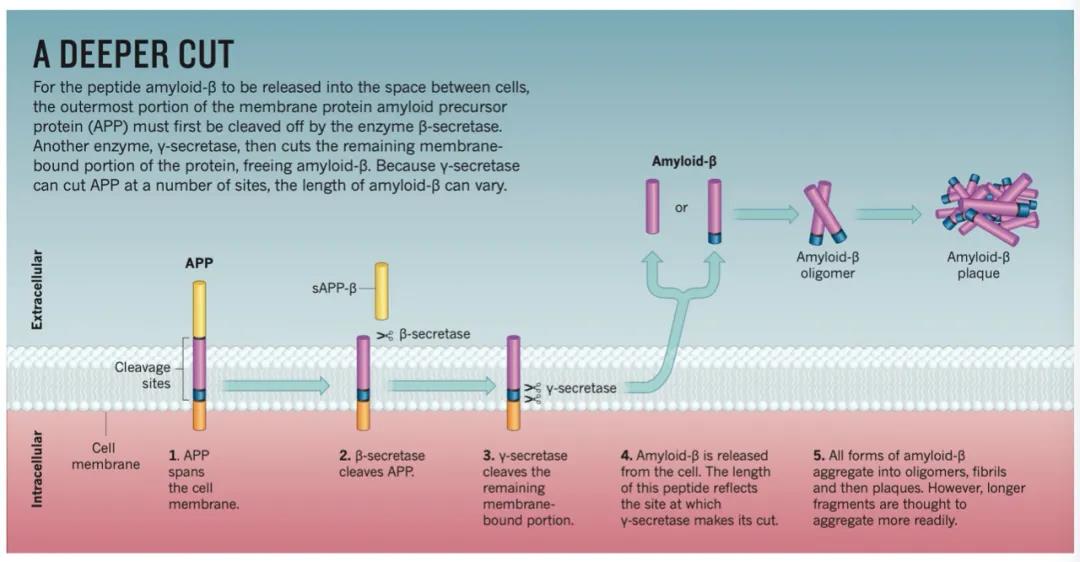
APP兩種不同的(de)切割位點(圖片來(lái)源:參考文獻【18】)
雖然目前已經有大(dà)量證據支持澱粉樣蛋白假說,但讓假說變成真理(lǐ)的(de)方式隻有一個(gè):證明(míng)靶向Aβ的(de)藥物(wù)可(kě)以延緩AD的(de)疾病進展。
然而,這(zhè)條路布滿了(le)荊棘。不管是緻力于清除Aβ的(de)免疫療法,還(hái)是各種降低Aβ産生和(hé)聚集的(de)療法都相繼墜入天坑。
2002年,首款靶向Aβ的(de)免疫療法宣告失敗,在這(zhè)項試驗中6%的(de)參與者出現了(le)大(dà)腦(nǎo)和(hé)腦(nǎo)膜炎症【19】。2011年,首個(gè)進入臨床三期的(de)γ分(fēn)泌酶抑制劑Semagacestat遭遇慘敗,這(zhè)種藥物(wù)不但使患者皮膚癌的(de)發病率升高(gāo),而且還(hái)加重了(le)認知障礙【20】。
2012年,禮來(lái)公司的(de)單抗藥物(wù)Solanezumab治療輕度到中度AD患者的(de)兩項三期研究Expedition1和(hé)Expedition2宣告失敗【21】,澱粉樣蛋白假說再遭重創。
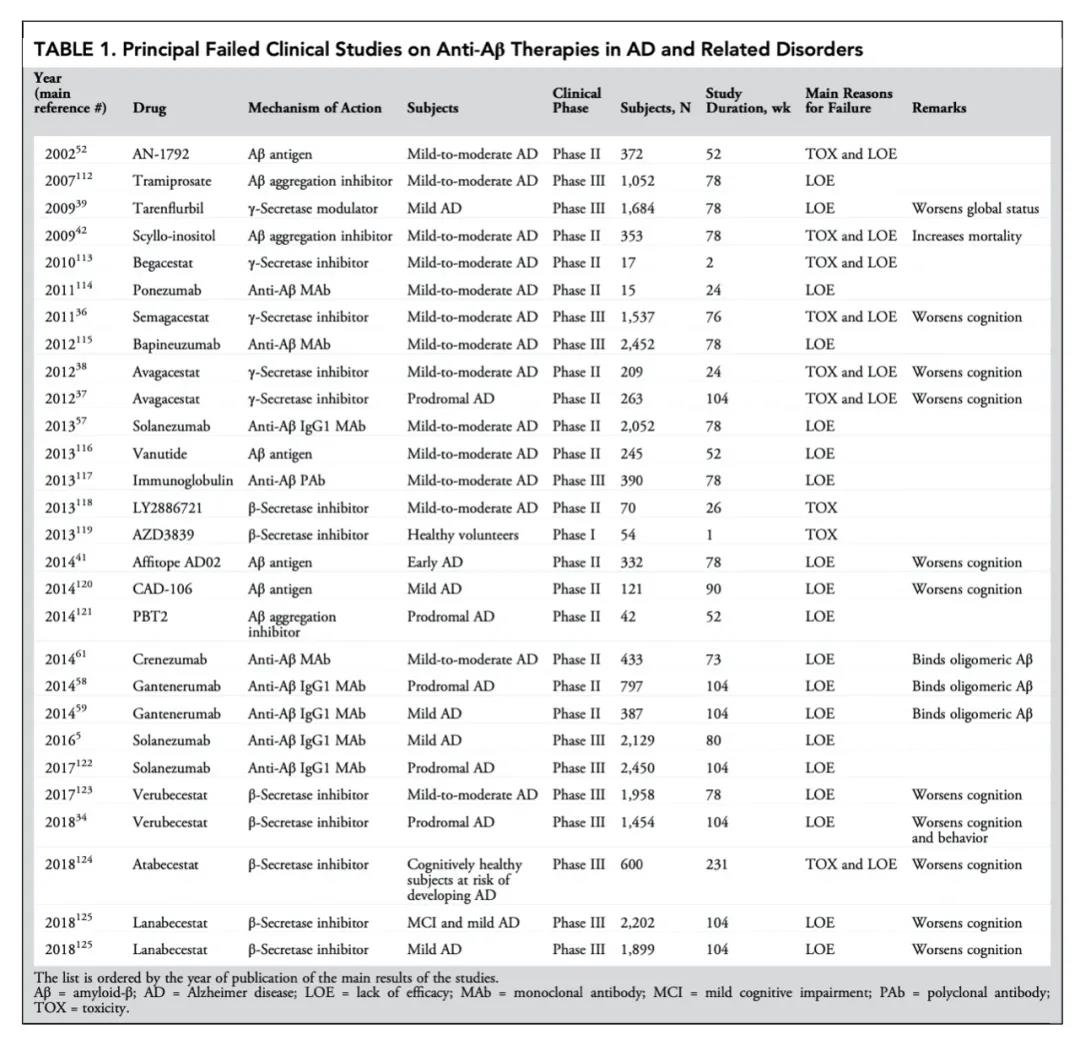
靶向Aβ藥物(wù)失敗的(de)臨床研究
(圖片來(lái)源:參考文獻【22】)
接連的(de)失敗促使科學家開始反思這(zhè)些研究。對(duì)于某些研究,失敗的(de)主因在于藥物(wù)本身。以γ分(fēn)泌酶抑制劑Semagacestat爲例,γ分(fēn)泌酶除了(le)切割APP之外,還(hái)負責切割各種其他(tā)類型的(de)蛋白,簡單地抑制γ分(fēn)泌酶必然會引起各種各樣的(de)副作用(yòng)。
除此之外,一個(gè)最爲主流的(de)判斷認爲:不是藥不行,是治得(de)太晚了(le)。Aβ的(de)沉積在AD症狀出現之前的(de)10~20年就已經出現,當疾病發展到癡呆階段時(shí)再治療爲時(shí)已晚。
----------THE END----------
免責聲明(míng):本文系轉載分(fēn)享,文章(zhāng)觀點、内容、圖片及版權歸原作者所有,如涉及侵權請聯系删除!