基因治療是指将外源正常基因導入靶細胞,以糾正或補償缺陷和(hé)異常基因引起的(de)疾病,達到治療目的(de)。基因治療的(de)爆發起源于20世紀90年代初,随著(zhe)人(rén)類對(duì)基因治療的(de)認識不斷加深,基因療法也(yě)愈來(lái)愈成熟,經過三十幾年科學技術的(de)發展,全球的(de)基因治療行業已經大(dà)步邁向成長(cháng)期,在某些适應證上基因治療已經比傳統的(de)治療方案更加有優勢。
2019年5月(yuè),全球首個(gè)治療輸血依賴型β地中海貧血(TDT)的(de)基因療法Zynteglo(LentiGlobin,bb1111,含βA-T87Q珠蛋白編碼基因的(de)自體CD34+細胞)獲得(de)歐洲藥品管理(lǐ)局(EMA)有條件批準,其研發公司爲藍鳥生物(wù)公司(bluebird bio)。Zynteglo是一種一次性基因療法,開發用(yòng)于治療β 地中海貧血和(hé)鐮狀細胞病(SCD)。2020年9月(yuè),EMA已授予Zynteglo治療SCD的(de)優先藥物(wù)資格(PRIME),此前,EMA還(hái)授予了(le)Zynteglo治療SCD的(de)孤兒(ér)藥資格(ODD);在美(měi)國,FDA授予了(le)Zynteglo治療SCD的(de)ODD、快(kuài)速通(tōng)道資格(FTD)、再生醫學先進療法資格(RMAT)、罕見兒(ér)科疾病資格(RPDD)。
目前,LentiGlobin基因療法用(yòng)于治療SCD正處于臨床研究階段,臨床開發計劃包括已完成的(de)1/2期HGB-205研究、正在進行的(de)1/2 期(HGB-206)和(hé)3期(HGB-210)臨床研究。但這(zhè)個(gè)适應症的(de)開發過程就沒有β 地中海貧血那麽順利,2021年2月(yuè)16日,藍鳥生物(wù)宣布停止基因療法LentiGlobin治療SCD的(de)1/2期和(hé)3期臨床研究,原因是參加其基因療法LentiGlobin1/2 期(HGB-206)臨床試驗的(de)SCD患者中分(fēn)别出現一例患急性髓細胞白血病(AML)和(hé)一例骨髓細胞異常增生症(MDS)。2月(yuè)23日,FDA發布公告稱将藍鳥公司治療SCD的(de)LentiGlobin基因治療臨床試驗方案擱置。在經過FDA近一月(yuè)的(de)審查後,藍鳥生物(wù)宣布,其LentiGlobin基因療法是“極不可(kě)能(very unlikely)”導緻接受治療的(de)鐮狀細胞病患者出現AML的(de),數據證明(míng)LentiGlobin基因療法并不會使患者出現異常綜合征,藍鳥生物(wù)現在正與FDA談判計劃恢複臨床試驗。
無獨有偶,在2020年8月(yuè)時(shí),FDA也(yě)拒絕過BioMarin的(de)治療A型血友病的(de)基因療法BMN270,因懷疑血友病患者接受基因治療不能終身受益,要求BioMarin提供所有研究參與者的(de)兩年随訪安全性和(hé)有效性數據;此後,不到半年的(de)時(shí)間,UniQure的(de)一項針對(duì)B型血友病的(de)基因療法也(yě)被美(měi)國FDA叫停,起因是一位志願者患肝癌。針對(duì)這(zhè)些問題,BioMarin 仍然希望其療法獲得(de)批準;UniQure 認爲癌症病例不太可(kě)能與治療相關,臨床試驗也(yě)在繼續進行中。
這(zhè)一次的(de)烏龍事件也(yě)隻是讓大(dà)家虛驚一場(chǎng),基因治療手段仍然被寄予厚望,Zynteglo的(de)獲批是一個(gè)好的(de)開始,國内外藥企對(duì)于血液疾病的(de)基因治療持續布局,下(xià)一個(gè)上市的(de)基因治療藥物(wù)能否花落血液疾病領域,也(yě)讓我們拭目以待。
1、基因療法用(yòng)于血友病
血友病(Hemophilia)是一種X染色體連鎖的(de)隐性遺傳性出血性疾病,可(kě)分(fēn)爲血友病A(血友病甲,缺乏凝血因子Ⅷ,患病人(rén)數約占80%~85%)、血友病B(血友病乙,缺乏凝血因子Ⅸ,患病人(rén)數約占15%~20%)和(hé)血友病C(血友病丙,缺乏凝血因子Ⅺ,罕見)。患者因凝血因子基因缺陷導緻凝血功能障礙,終身具有輕微創傷後出血傾向,重症患者沒有明(míng)顯外傷也(yě)可(kě)發生“自發性”出血。血友病患者自出生時(shí)即可(kě)發病,伴随終身,如果得(de)不到标準規範的(de)治療,緻殘及緻死率很高(gāo)。
目前臨床上治療血友病常規方案是替代治療,即給患者補充所缺乏的(de)凝血因子,但這(zhè)種方案存在缺陷,如凝血因子在體内半衰期短,需反複注射等,不能治愈,需要終身治療,但仍有出血風險,這(zhè)不僅影(yǐng)響患者的(de)正常生活,且治療費用(yòng)昂貴,給患者帶來(lái)很大(dà)的(de)經濟負擔。已上市的(de)凝血因子代表産品如:Baxalta的(de)Advate/Recombinate,諾和(hé)諾德的(de)Novoseven,拜耳公司的(de)KogenateFS等。Biogen的(de)長(cháng)效凝血因子Alprolix和(hé)Eloctate、拜耳的(de)重組長(cháng)效凝血因子 Kovaltry 也(yě)相繼獲批上市,長(cháng)效凝血因子藥物(wù)的(de)市場(chǎng)和(hé)地位不斷拓展和(hé)鞏固。
近年來(lái),市面上也(yě)出現了(le)治療血友病的(de)創新藥,如羅氏的(de)Hemlibraâ(Emicizumab,艾美(měi)賽珠單抗)是血友病藥物(wù)研發20年來(lái)首個(gè)獲得(de)FDA批準的(de)用(yòng)于治療A型血友病的(de)新藥。根據2019年羅氏财報,Hemlibra年銷售額達13.8億瑞士法郎,增長(cháng)超500%,Hemlibra需每周皮下(xià)注射一次,按照(zhào)羅氏的(de)定價,患者需要承擔第一年48.2萬美(měi)元、此後44.8萬美(měi)元/年的(de)用(yòng)藥成本。
基因療法對(duì)血友病的(de)治療提供了(le)“一勞永逸”的(de)新思路,傳統藥物(wù)及像Hemlibra等新型抗體藥物(wù)将直面基因療法的(de)沖擊。早在1991年,我國科學家就進行了(le)世界上首例血友病B的(de)基因治療臨床試驗。現階段多(duō)個(gè)基因治療臨床試驗已經表現出了(le)良好的(de)療效與進展,如BioMarin公司的(de)A型血友病基因療法BMN 270已于近期提交了(le)BLA申請,Sangamo/輝瑞的(de)SB-525也(yě)處于III期臨床階段,血友病的(de)用(yòng)藥市場(chǎng)格局即将被基因療法所改變。
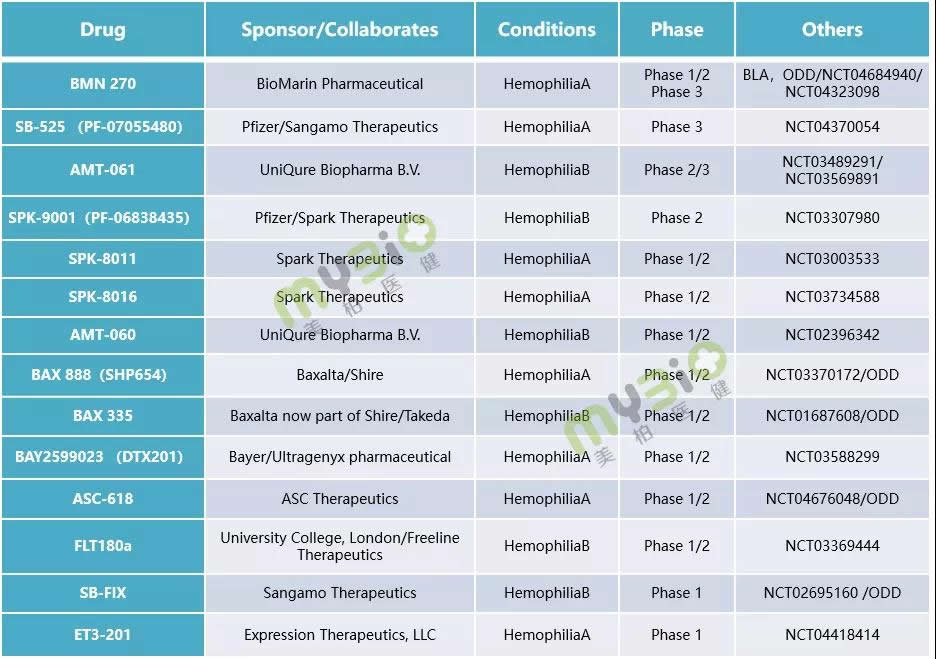
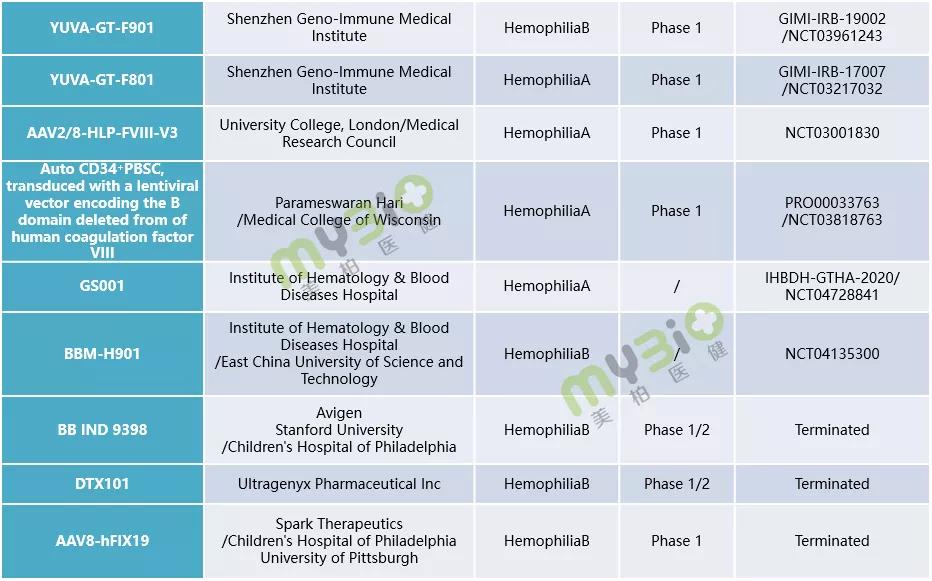
▲表1 處于臨床階段的(de)部分(fēn)血友病基因治療候選療法
數據來(lái)源:https://www.clinicaltrials.gov
血友病基因治療的(de)主要模式爲載體介導和(hé)細胞介導。載體介導即利用(yòng)載體将目的(de)基因轉入靶細胞,使其在靶細胞中表達。細胞介導即提取患者細胞并利用(yòng)ZFN、TALEN或CRISPR/Cas9等基因編輯技術進行基因改造,擴增後移植入患者體内。基因治療可(kě)以使血友病患者體内自行表達FVIII或FIX,甚至可(kě)達正常水(shuǐ)平,這(zhè)使之成爲“一次性”治愈血友病的(de)唯一手段。
研發基因療法用(yòng)于治療血友病的(de)代表公司:
(1)BioMarin
BioMarin創立于1996年,總部位于美(měi)國,是一家針對(duì)慢(màn)性基因性疾病研發的(de)公司。
BioMarin的(de)候選産品BMN 270正在進行3期臨床試驗,已經獲得(de)美(měi)國FDA授予的(de)孤兒(ér)藥和(hé)突破性療法認定,也(yě)已獲得(de)而歐盟PRIME資格。其生物(wù)制品許可(kě)申請(BLA)已被FDA受理(lǐ),優先審核用(yòng)于治療嚴重A型血友病患者,這(zhè)是美(měi)國第一個(gè)針對(duì)血友病的(de)基因治療産品,也(yě)是有望成爲第一個(gè)被批準用(yòng)于治療A型血友病患者的(de)基因療法。
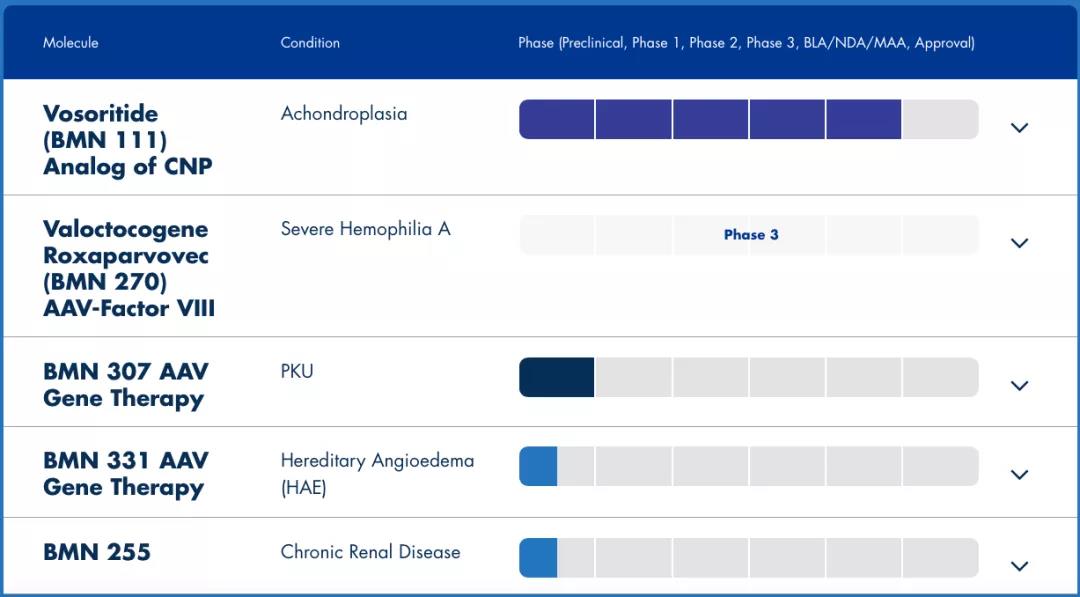
▲圖片來(lái)源:BioMarin官方網站
(2)Spark Therapeutics
Spark成立于2013年,總部位于賓夕法尼亞,是一家專注于遺傳疾病基因治療産品開發的(de)公司,2019年12月(yuè),羅氏以48億美(měi)金的(de)價格完成對(duì)Spark的(de)收購(gòu)。
Spark最初是研究罕見病特效孤兒(ér)藥的(de)公司,2017年年底,其針對(duì)罕見眼科疾病的(de)基因療法Luxturna獲FDA批準,成爲首個(gè)在美(měi)國上市的(de)基因療法。其兩款治療血友病的(de)明(míng)星産品SPK-9001和(hé)SPK-8011在臨床上也(yě)表現出很好的(de)療效,此外,另一款基于AAV載體表達凝血因子VIII的(de)基因療法SPK-8016也(yě)處于臨床階段。
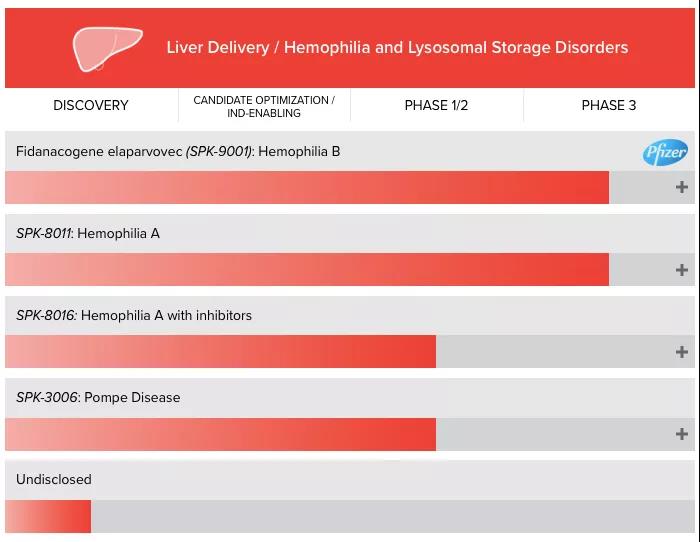
▲圖片來(lái)源:Spark官方網站
(3)UniQure
UniQure創立于1998年,總部位于荷蘭,是一家從事基因治療藥物(wù)開發的(de)生物(wù)制藥公司。UniQure擁有歐洲上市的(de)首個(gè)基因療法Glybera,用(yòng)于治療脂蛋白脂酶缺乏症(LPLD)。
2020年6月(yuè),UniQure宣布與CSL Behring簽訂許可(kě)協議(yì), CSLBehring獲得(de)UniQure在B型血友病适應症上的(de)的(de)基因治療産品AMT-061的(de)全球獨家權利,總交易額超20億美(měi)元。
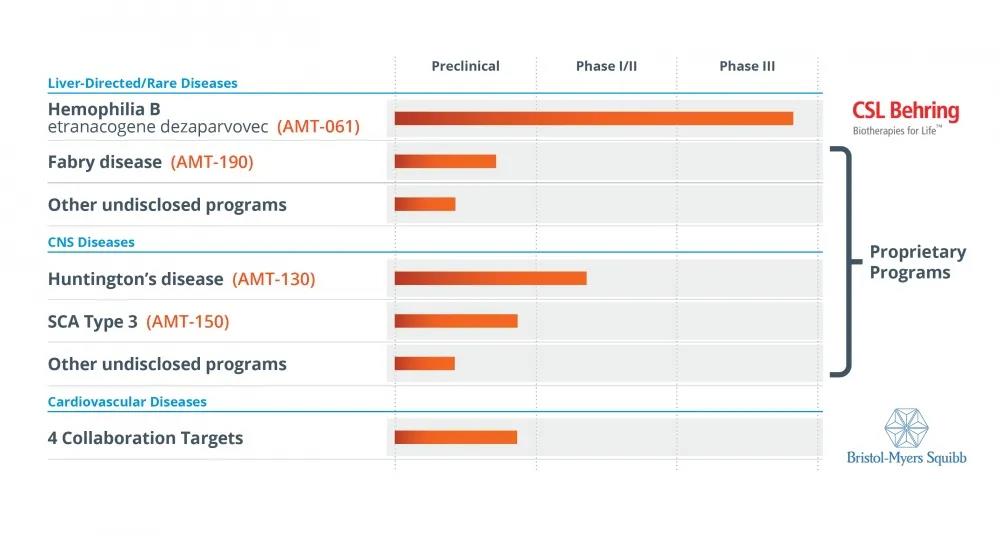
▲圖片來(lái)源:UniQure官方網站
(4)Sangamo Therapeutics
Sangamo創立于1995年,總部位于美(měi)國,是一家專注于基因編輯、基因治療和(hé)細胞治療平台技術的(de)生物(wù)制藥公司。Sangamo在ZFN基因編輯技術上深耕20餘年,ZFN技術相關的(de)專利基本由該公司持有,獲得(de)包括鋅指蛋白設計、篩選、優化(huà)、實驗室及臨床應用(yòng)等多(duō)項專利。
2017年5月(yuè),Sangamo與Pfizer就一款A型血友病基因療法SB-525,簽署了(le)全球獨家合作和(hé)許可(kě)協議(yì),交易金額達5.45億美(měi)元。目前,FDA已授予SB-525孤兒(ér)藥地位和(hé)快(kuài)速通(tōng)道認定。此外,2018年12月(yuè),Sangamo宣布1/2期臨床試驗評估SB-FIX的(de)第一位患者進行治療,這(zhè)是全球首個(gè)利用(yòng)鋅指核酸酶(ZFN)技術并且針對(duì)B型血友病的(de)在體基因編輯臨床試驗,且該療法在2016年便獲FDA授予的(de)孤兒(ér)藥資格。
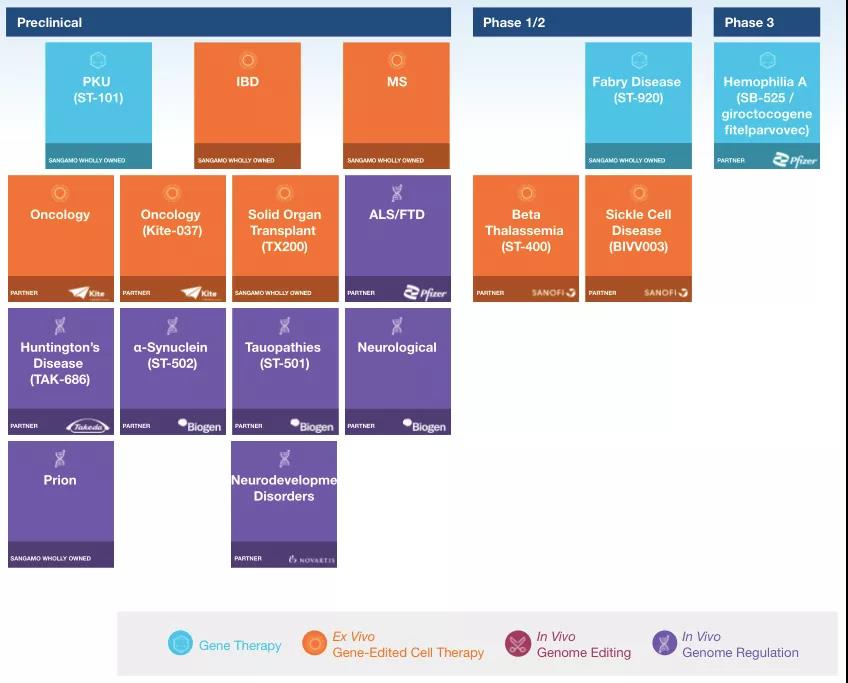
▲圖片來(lái)源:Sangamo官方網站
(5)ASC Therapeutics
ASC Therapeutics是一家快(kuài)速發展的(de)生物(wù)技術公司,通(tōng)過其專有的(de)基因編輯平台TARGATTTM和(hé)其他(tā)基因編輯技術開發治療型産品,爲尚珹投資在醫療領域的(de)投資項目之一。
目前研發管線包括幾個(gè)臨床前階段的(de)項目,重點關注血液病的(de)研究。根據clinicaltrials.gov顯示,2021年4月(yuè),ASC Therapeutics公司将開展ASC-618治療中重度血友病A的(de)安全性及初步療效評價臨床研究。另外,管線上還(hái)有治療A型血友病的(de)基因療法ASC-518、治療B型血友病的(de)基因療法ASC-519及治療β 地中海貧血的(de)基因療法ASC-520處于早期研究階段。
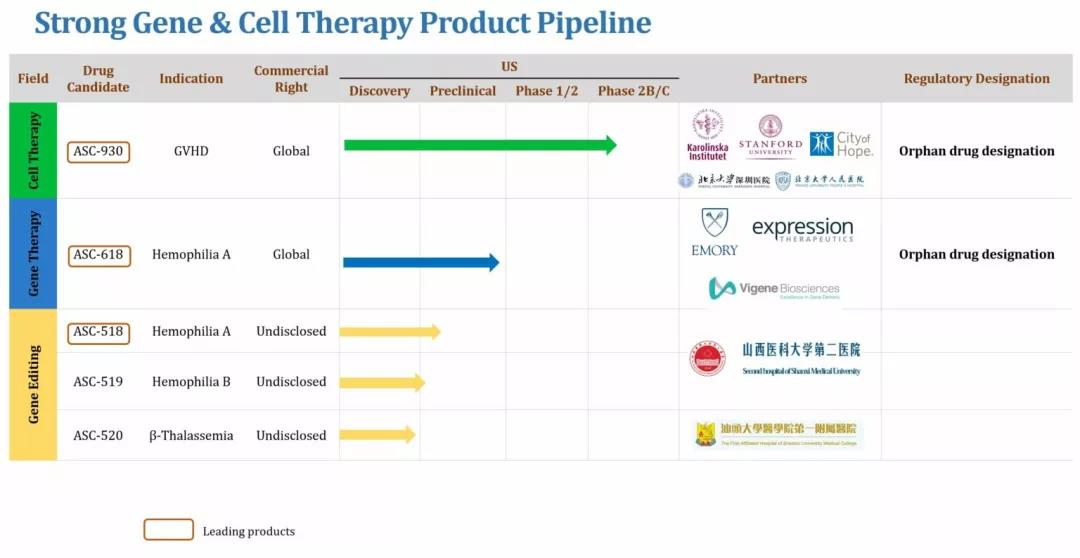
▲圖片來(lái)源:ASC Therapeutics官方網站
(6)Freeline Therapeutics
Freeline創立于2015年,主要專注于利用(yòng)基因療法的(de)潛力爲患有慢(màn)性全身性疾病的(de)病人(rén)提供治愈性治療方法。Freeline開發了(le)一種改進的(de)AAV病毒衣殼,這(zhè)種強大(dà)的(de)衣殼在B型血友病患者的(de)臨床試驗中得(de)到驗證。

2018年,Freeline完成1.16億美(měi)元(約合人(rén)民币7.54億元)的(de)B輪融資,以推動其主打産品用(yòng)于治療B型血友病和(hé)法布裏病的(de)臨床開發,以及其他(tā)産品管線的(de)進展。同時(shí)新融資也(yě)将幫助Freeline進一步提高(gāo)其基于AAV(腺相關病毒)衣殼的(de)生産和(hé)進一步優化(huà)能力。

▲圖片來(lái)源:Freeline官方網站
(7)Ultragenyx Pharmacetical
Ultragenyx成立于2010年,總部位于加利福尼亞,是一家專注罕見病新藥的(de)研發和(hé)商業化(huà)的(de)生物(wù)醫藥公司。
Ultragenyx與拜耳合作開發的(de)用(yòng)于治療A型血友病的(de)基因療法BAY2599023 (DTX201)使用(yòng)的(de)是Regenxbio專有的(de)NAV AAVhu37載體。DTX201最初是由Dimension研發,Ultragenyx于2017年11月(yuè)完成對(duì)Dimension Therapeutics的(de)收購(gòu),獲得(de)該産品。根據clinicaltrials.gov顯示,拜耳于2018年11月(yuè)啓動BAY2599023(DTX201)關于成人(rén)嚴重血友病A的(de)臨床試驗研究,這(zhè)也(yě)是Bayer産品管線中唯一一款處于臨床階段的(de)治療血友病的(de)基因療法。
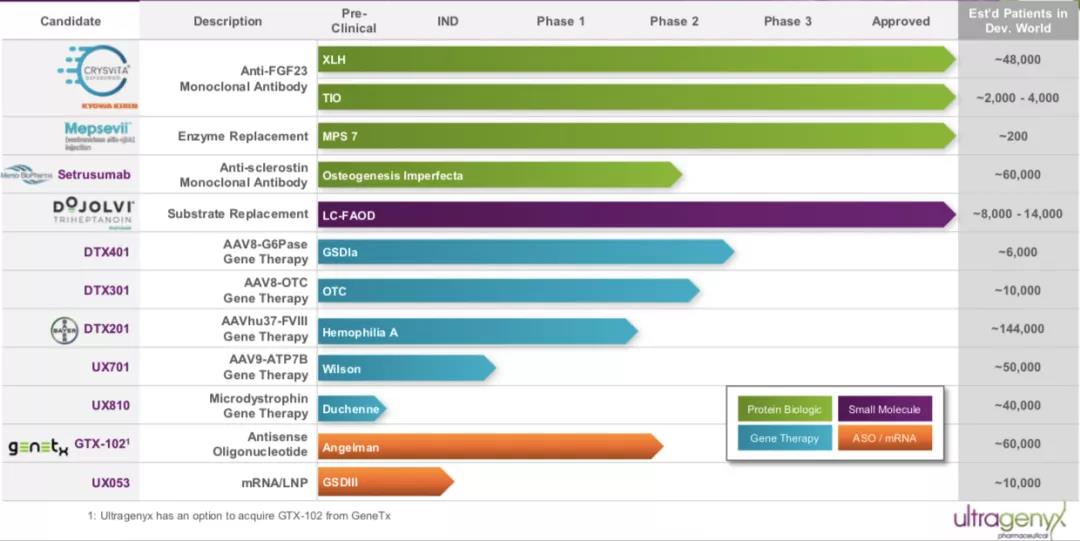
▲圖片來(lái)源:Ultragenyx官方網站
另外值得(de)一提的(de)是基因治療領域的(de)新秀Regenxbio,Regenxbio緻力于AAV(Adeno-associated virus,重組腺相關病毒)基因療法的(de)開發和(hé)商業化(huà)。Regenxbio擁有的(de)NAV技術平台是一種專有的(de)AAV基因遞送平台,包括100多(duō)種新型AAV載體,比如AAV7、AAV8、AAV9和(hé)AAVrh10。

目前,Regenxbio已将NAV技術許可(kě)給10餘家公司,并據此開發了(le)超20個(gè)候選産品,主要用(yòng)于治療神經退行性疾病、血液疾病、視網膜疾病等适應症,合作方包括Novartis、Prevail、Pfizer、Takeda等企業。其中有2款治療A型血友病的(de)基因候選産品,目前分(fēn)别由Takeda和(hé)Ultragenyx/Bayer進行後續開發。
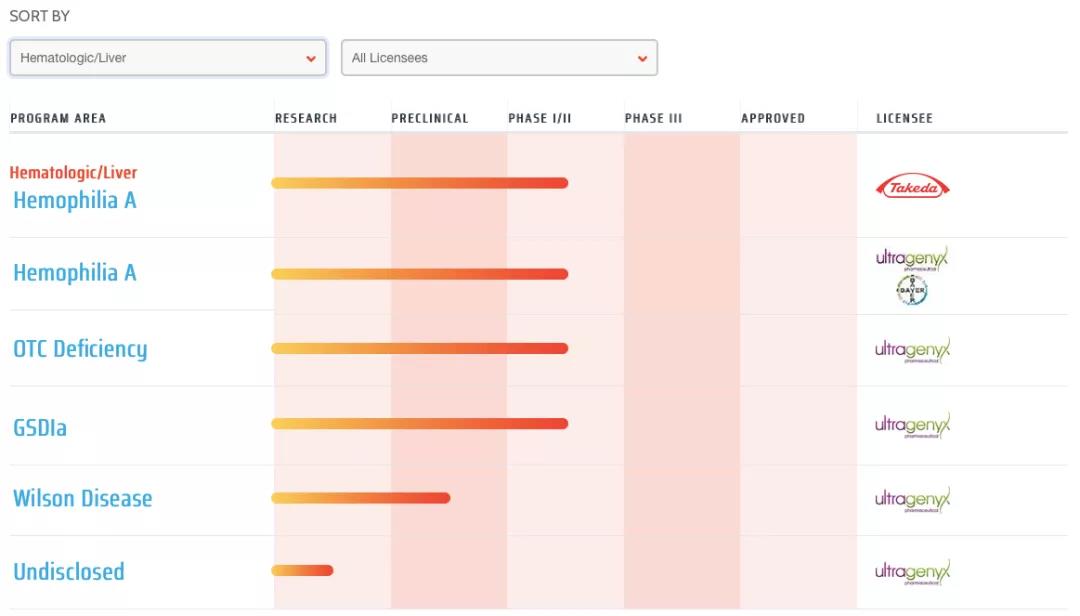
▲圖片來(lái)源:Regenxbio官方網站
(8)Generation Bio
Generation Bio創立于2016年,總部位于美(měi)國,是一家創新型基因藥物(wù)公司,利用(yòng)特有的(de)非病毒基因治療平台創建了(le)一類新型的(de)基因治療産品。其創新點在遞送系統,核心技術被稱爲non-viral closed-ended DNA(ceDNA),通(tōng)過脂質納米顆粒進入人(rén)體,這(zhè)項技術能避開基于病毒的(de)基因治療中典型的(de)免疫反應。Generation Bio自2018年來(lái),先後完成三輪融資,并于2020年5月(yuè)進行了(le)IPO,同年6月(yuè)于納斯達克上市。
Generation Bio的(de)産品線包括針對(duì)肝髒和(hé)視網膜的(de)罕見病和(hé)流行疾病的(de)八個(gè)項目,其中苯丙酮尿症(PKU)和(hé)A型血友病進展最快(kuài),處于臨床前研究階段。
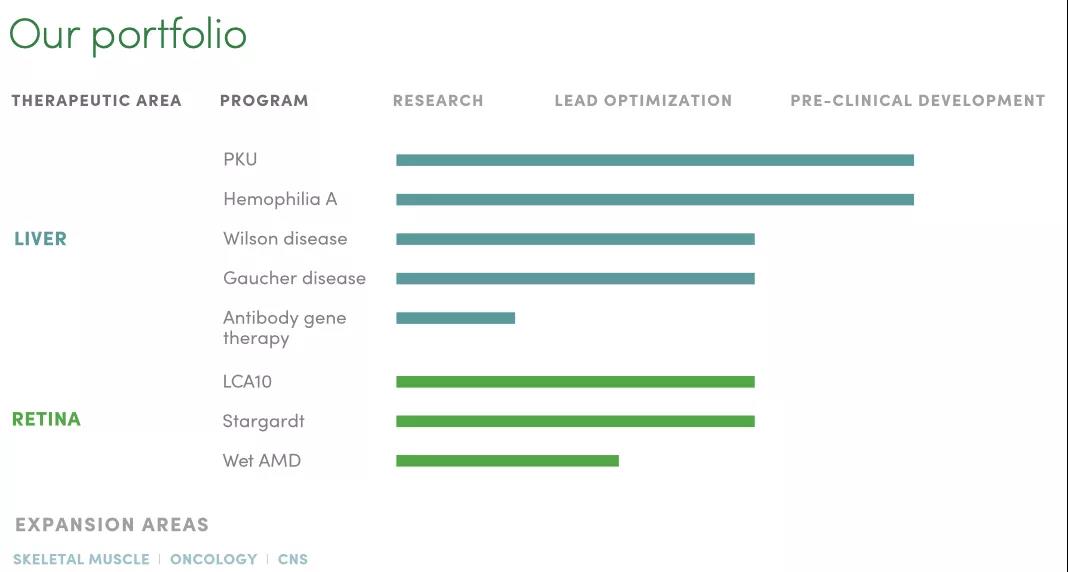
▲圖片來(lái)源:Generation Bio官方網站
(9)深圳市免疫基因治療研究院
深圳市免疫基因治療研究院是經深圳市人(rén)民政府批準設立的(de)具有獨立法人(rén)資格的(de)二類事業單位。研究院主要研究方向是針對(duì)癌症的(de)CAR-T免疫細胞治療及針對(duì)基因相關疾病的(de)治療。
深圳市免疫基因治療研究院采用(yòng)雙重幹細胞基因療法治療多(duō)項遺傳疾病,對(duì)七種基因疾病進行深入研究,包括異染性腦(nǎo)白質營養不良、腎上腺腦(nǎo)白質營養不良、地中海貧血、血友病、視網膜眼睛疾病、X連鎖嚴重聯合免疫缺陷和(hé)範可(kě)尼貧血。
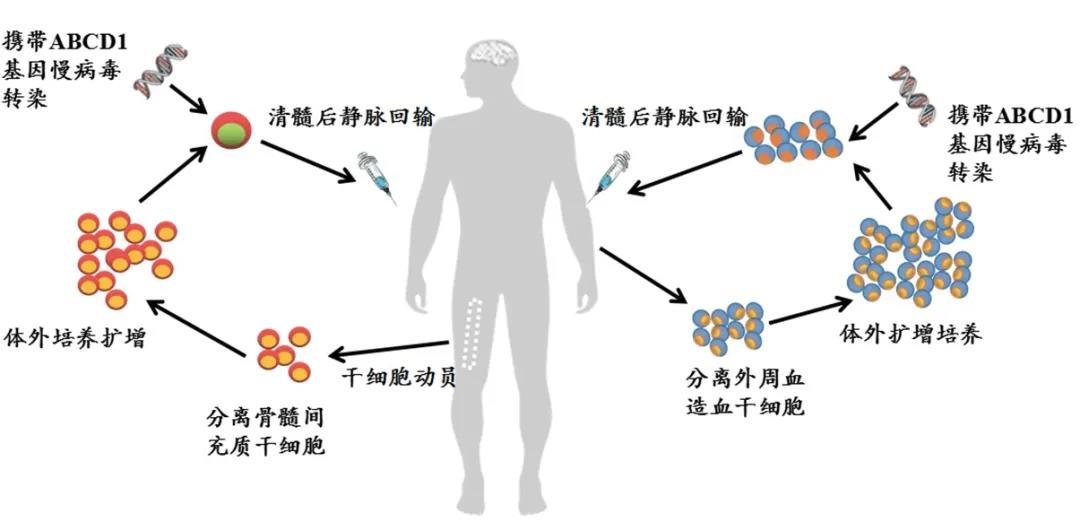
▲圖1 深圳市免疫基因治療研究院拟采用(yòng)的(de)雙重幹細胞基因治療示意圖
圖片來(lái)源:深圳市免疫基因治療研究院官方網站
雖然,我國在1991年就開展了(le)首個(gè)針對(duì)血友病的(de)基因治療臨床試驗,但是直到近幾年才有血友病基因療法進一步開展臨床階段。中國醫學科學院血液學研究所&血液病醫院與華東理(lǐ)工大(dà)學共同申請的(de)靜脈輸注基于AAV的(de)基因療法BBM-H901用(yòng)于治療血友病B臨床試驗(NCT04135300)于2019年10月(yuè)發起,這(zhè)也(yě)是國内首個(gè)AAV基因治療臨床試驗。
深圳市免疫基因治療研究院的(de)YUVA-GT-F801、YUVA-GT-F901分(fēn)别用(yòng)于治療A型血友病與B型血友病,目前也(yě)處于1期臨床試驗階段。
此外,深圳市免疫基因治療研究院還(hái)有關于地中海貧血、範可(kě)尼貧血的(de)基因治療試驗也(yě)正開展臨床。
(10)北(běi)京五加和(hé)基因科技有限公司
五加和(hé)基因成立于2005年,技術團隊從事病毒載體系統研究20餘年,公司緻力于爲pre-IND和(hé)IND階段基因藥物(wù)提供符合GMP标準的(de)病毒載體制品研發生産服務。

公司董事長(cháng)兼總經理(lǐ)董小岩博士在2000年建立本元正陽基因技術股份有限公司基因治療新藥研發平台。2003年,其自主研發使用(yòng)AAV載體的(de)血友病B基因藥物(wù)研發項目AAV2-hFIX獲批,系中國首個(gè)被批準的(de)血友病B基因治療藥物(wù)臨床方案。2005年創建北(běi)京五加和(hé),帶領團隊研發用(yòng)于治療B型血友病、A型血友病、SMA、DMD、ALS、遺傳性高(gāo)脂血症、青光(guāng)眼等26種疾病的(de)基因藥物(wù)。
(11)四川至善唯新生物(wù)科技有限公司
至善唯新成立于2018年,是一家專注rAAV基因藥物(wù)研發與颠覆式生産的(de)國内基因治療領軍企業。公司擁有基因療法領域的(de)專業團隊,創始人(rén)董飚從事rAAV病毒載體研究超過十年,在基因療法藥物(wù)設計與規模化(huà)生産方面均取得(de)了(le)突破性進展,治療領域涵蓋血液疾病、罕見病等多(duō)個(gè)疾病領域。
至善唯新擁有全球領先的(de)新型rAAV生産系統,針對(duì)A型血友病和(hé)B型血友病都有了(le)相應的(de)rAAV基因藥物(wù)臨床管線布局,已經完成臨床前的(de)動物(wù)模型驗證。其中,針對(duì)B型血友病的(de)臨床管線是公司眼下(xià)重點推進的(de)項目,利用(yòng)有自主專利的(de)規模化(huà)載體生産技術和(hé)高(gāo)效IX因子,開發治療B型血友病的(de)rAAV藥物(wù),該項目将于2021年提交臨床批件注冊申報。除布局血友病方向的(de)管線外,至善唯新利用(yòng)自身在于rAAV基因治療領域儲備的(de)技術優勢,在抗衰老和(hé)神經退行性疾病方向也(yě)有相應的(de)管線布局,包括針對(duì)帕金森症、老年癡呆症的(de)rAAV基因藥物(wù)研究等。
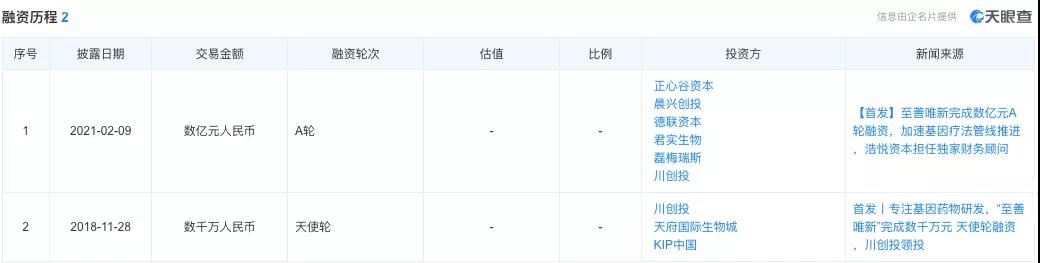
▲圖片來(lái)源:天眼查官方網站
至善唯新成立不足半年,便獲得(de)由川創投領投的(de)數千萬人(rén)民币天使輪融資;2021年2月(yuè),又完成了(le)數億元人(rén)民币的(de)A輪融資,用(yòng)來(lái)加速基因療法管線的(de)推進,其中,君實生物(wù)持有至善唯新約6.6%的(de)股權。
(12)信念醫藥科技(蘇州)有限公司
信念醫藥成立于2018年,緻力于基因治療藥物(wù)的(de)産業化(huà)研發和(hé)臨床應用(yòng),包括腺相關病毒基因治療載體的(de)前端篩選、生産工藝優化(huà)、GMP生産、臨床質控标準和(hé)臨床試驗等。信念醫藥計劃從生物(wù)科技公司逐步轉型爲生物(wù)醫藥公司,目前已完成數千萬的(de)天使輪與數億元的(de) A 輪融資。
信念的(de)産品布局主要專注在開發以AAV爲載體的(de)基因療法,産品線包括血友病 A、血友病 B、帕金森症、老年黃(huáng)斑變性、粘多(duō)糖貯積症、肌萎縮側索硬化(huà)症、遺傳性血管水(shuǐ)腫、嗜血細胞綜合征、法布裏疾病等适應症,其中研發最快(kuài)的(de)兩個(gè)産品就是血友病B和(hé)血友病A。
華東理(lǐ)工大(dà)學與血液所申報的(de)血友病基因治療産品BBM-H901正是出自信念醫藥的(de)子公司上海信緻醫藥科技有限公司臨床藥物(wù)生産場(chǎng)地,位于華東理(lǐ)工大(dà)學國家大(dà)學科技園梅隴基地内。
此外,國際上還(hái)有很多(duō)公司正在積極布局血友病基因治療産品,如諾和(hé)諾德與藍鳥生物(wù)于2019年10月(yuè)達成合作協議(yì),雙方合作重點利用(yòng)藍鳥生物(wù)的(de)megaTAL技術開發A型血友病的(de)基因療法;再生元與Intellia Therapeutics擴大(dà)雙方自2016年的(de)合作,交易額達1億美(měi)元,雙方合作重點是開發治療A型血友病和(hé)B型血友病的(de)潛在CRISPR / Cas9編輯基因治療候選藥物(wù);賽諾菲與合作已久的(de)慢(màn)病毒載體開發商Oxford BioMedica(OXB)利用(yòng)其開發和(hé)生産用(yòng)于治療血友病的(de)慢(màn)病毒載體,首次開發基于慢(màn)病毒的(de)體内給藥血友病基因療法等。
2、基因療法用(yòng)于β地中海貧血
地中海貧血(Thalassemia,地貧)即珠蛋白生成障礙性貧血,是一組常染色體遺傳的(de)溶血性貧血疾病,其緻病機制是珠蛋白基因缺陷使血紅蛋白中的(de)珠蛋白肽鏈有一種或幾種合成減少或不能合成,導緻血紅蛋白的(de)組成成分(fēn)改變,進而引發紅細胞壽命縮短,表現爲慢(màn)性溶血性貧血。根據珠蛋白鏈缺乏種類不同,地中海貧血分(fēn)爲α型、β型、δβ型、δ型和(hé)ebgδ型,其中臨床上以β和(hé)α型地貧最爲常見,α-地貧又分(fēn)靜止型、輕型、中間性和(hé)重型;β-地貧又分(fēn)輕型、中間型和(hé)重型。
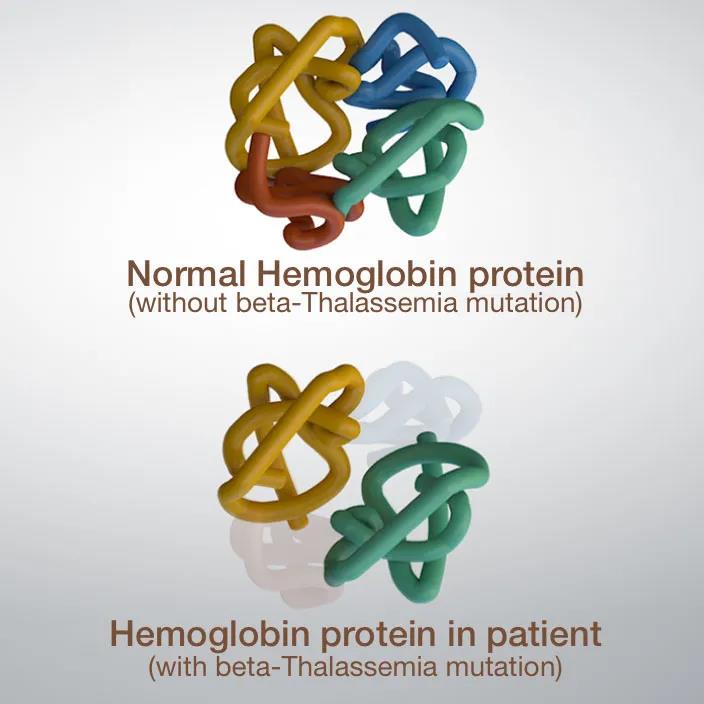
▲圖2 β-地貧緻病機制示意圖
圖片來(lái)源:Learn. Genetics,Gene TherapySuccesses
目前,針對(duì)β-地貧的(de)療法有輸血替代治療、脾髒切除和(hé)造血幹細胞移植治療等。其中定期輸血是臨床上比較常規的(de)治療方案,患者需要終身治療,治療費用(yòng)昂貴且易産生輸血副反應,還(hái)須同時(shí)接受去鐵治療,但去鐵治療也(yě)同樣會伴随嚴重不良反應,常用(yòng)鐵螯合劑包括得(de)斯芬、奧貝安可(kě)、恩瑞格等;對(duì)于經正常輸血治療及去鐵治療後鐵負荷仍增加的(de)患者考慮脾髒切除,但此治療方案會增加嚴重敗血症發生的(de)風險,且對(duì)重症β-地貧患者效果仍差強人(rén)意;造血幹細胞移植治療是目前能夠根治的(de)唯一方案,可(kě)通(tōng)過骨髓移植、外周血幹細胞移植、臍血移植等方案将健康人(rén)的(de)造血幹細胞移植至病人(rén)體内,但配型十分(fēn)困難,且供體來(lái)源有限,即使配型成功仍需長(cháng)期服用(yòng)免疫抑制藥物(wù),治療費用(yòng)也(yě)十分(fēn)昂貴。
在β 地中海貧血(TDT)治療領域,也(yě)有一些新藥獲批,BMS的(de)Reblozyl就是第一個(gè)獲FDA批準治療β 地中海貧血相關貧血的(de)藥物(wù),同時(shí)也(yě)是十多(duō)年來(lái)第一個(gè)獲FDA批準用(yòng)于需要輸注紅細胞(RBC)且接受一種紅細胞生成刺激劑治療失敗的(de)骨髓增生異常綜合症(MDS)患者的(de)新治療方案。特别值得(de)注意的(de)是,在需要立即糾正貧血的(de)患者中,Reblozyl不适用(yòng)于作爲紅細胞輸注的(de)替代品。此前,華爾街(jiē)投行Jefferies分(fēn)析師預測,Reblozyl獲FDA批準後的(de)年銷售峰值将達到20億美(měi)元。
基因療法爲β地中海貧血提供了(le)新的(de)治療思路,将造血幹細胞從病人(rén)自身的(de)外周血中收集後,通(tōng)過病毒載體導入正常的(de)珠蛋白基因以使細胞功能恢複正常,再将改造後的(de)造血幹細胞回輸給病人(rén)。這(zhè)種治療方案的(de)優勢在于,供體來(lái)源不需要通(tōng)過捐贈、異體移植,解決了(le)幹細胞來(lái)源不足以及配型困難等問題,一次治療就可(kě)能滿足永久性的(de)“治愈”,有望取代目前并不完美(měi)的(de)治療方案。
2019年5月(yuè),全球首個(gè)治療輸血依賴型β地中海貧血的(de)基因療法Zynteglo獲得(de)歐洲藥品管理(lǐ)局(EMA)有條件批準,也(yě)有多(duō)家企業正在進行β 地中海貧血基因療法的(de)臨床及臨床前的(de)實驗研究。
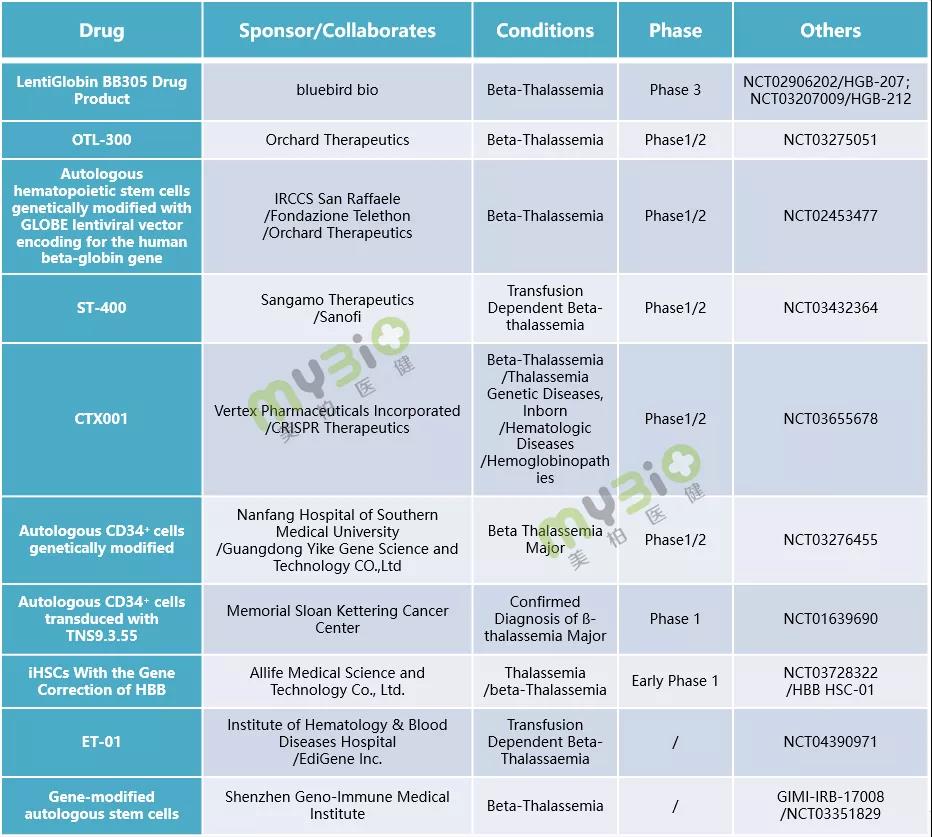
▲表2 處于臨床階段的(de)部分(fēn)β 地中海貧血基因治療候選療法
數據來(lái)源:https://www.clinicaltrials.gov
這(zhè)種一次性的(de)基因治療方法,可(kě)直接解決β地中海貧血的(de)内在基因病因,有潛力使患者擺脫輸血依賴(輸血非依賴),一旦成功,患者将終身受益。
研發基因療法用(yòng)于治療β地中海貧血的(de)代表公司:
(1)bluebird bio
藍鳥生物(wù)公司(bluebird bio)創立于1992年,總部位于美(měi)國,原名Genetix Pharmaceuticals, Inc.,于2010年9月(yuè)改爲bluebird bio,是一家緻力于爲治療嚴重的(de)遺傳疾病和(hé)罕見疾病開發革命性基因療法的(de)臨床階段生物(wù)技術公司。

藍鳥生物(wù)的(de)基因産品LentiGlobin治療β 地中海貧血已獲EMA批準,這(zhè)是針對(duì)β-地中海貧血的(de)首款基因療法,LentiGlobi
n的(de)另一适應症SCD正處于臨床研究階段。
▲圖片來(lái)源:bluebird bio官方網站
(2)Orchard Therapeutics
Orchard成立于2015年,位于英國,是一家緻力于爲患有嚴重和(hé)危及生命的(de)孤兒(ér)疾病的(de)患者提供變革性基因治療的(de)公司,将利用(yòng)離體自體造血幹細胞基因治療的(de)潛力來(lái)恢複正常的(de)基因功能。

OTL-300是一種實驗性自體體外慢(màn)病毒基因療法,2018年4月(yuè),Orchard從葛蘭素史克收購(gòu)該基因療法,EMA已授予OTL-300治療TDT的(de)優先藥物(wù)資格。繼收購(gòu)GSK基因療法後,Orchard獲1.5億美(měi)元C輪融資,随後IPO上市。
▲圖片來(lái)源:Orchard官方網站
(3)CRISPR Therapeutics/Vertex
CRISPR Therapeutics于2013年10月(yuè)成立于瑞士,研究中心在馬薩諸塞州劍橋,由獲得(de)2020年諾貝爾化(huà)學獎的(de)Emmanuelle Charpentier及其同事創立,緻力于利用(yòng)其專利 CRISPR/Cas9 基因編輯平台開發革命性藥物(wù)。Vertex成立于1989年,是一家緻力于開發治療嚴重疾病藥物(wù)的(de)生物(wù)技術公司,囊性纖維化(huà)治療領域的(de)全球領導者,目前已上市多(duō)款囊性纖維化(huà)療法。CRISPR Therapeutics與Vertex也(yě)建立了(le)戰略合作夥伴關系,開發基于CRISPR技術的(de)基因治療方案。

2015年,CRISPR與Vertex達成合作,雙方協議(yì)利用(yòng)CRISPR/Cas9 基因編輯技術去發現和(hé)開發針對(duì)人(rén)類疾病内在基因原因的(de)潛在新療法,CTX001就是利用(yòng)這(zhè)項合作的(de)首個(gè)成果。2018年,CTX001獲得(de)了(le)美(měi)國和(hé)歐洲監管機構的(de)新藥研究申請批件,這(zhè)也(yě)是全球首個(gè)由制藥公司發起的(de)體外CRISPR療法的(de)新藥臨床試驗。目前,CTX001處于I/II期臨床試驗階段,獲得(de)了(le)FDA 授予的(de)再生醫學高(gāo)級療法(RMAT)、快(kuài)速審評通(tōng)道、孤兒(ér)藥和(hé)罕見兒(ér)科疾病藥物(wù)稱号,還(hái)獲得(de)EMA授予的(de)針對(duì)鐮狀細胞病和(hé) β 地中海貧血的(de)孤兒(ér)藥稱号以及針對(duì)鐮狀細胞病的(de)優先審評藥物(wù)資格。

▲圖片來(lái)源:CRISPR官方網站
(4)Editas Medicine
由CRISPR領域的(de)領軍人(rén)物(wù)張鋒和(hé)Jennifer Doudna共同創建的(de)Editas成立于2013年,是最早上市的(de)CRISPR-Cas9技術公司。
公司的(de)研發管線中治療伯氏先天性黑(hēi)蒙症的(de)EDIT-101

療法進展最快(kuài),已經進入臨床階段,其次是EDIT-301療法,用(yòng)于鐮狀細胞病與β 地中海貧血。
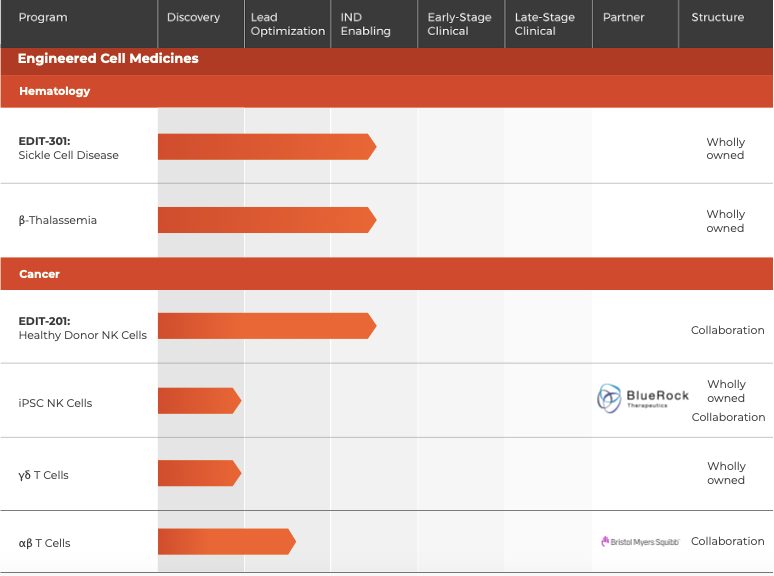
▲圖片來(lái)源:Editas官方網站
(5)Sangamo Therapeutics/Sanofi
上文提到,Sangamo與Pfizer合作開發A型血友病基因療法SB-525,Sangamo還(hái)與Sanofi合作将ZFN基因編輯技術應用(yòng)于輸血依賴性β-地中海貧血的(de)治療,其相關産品ST-400處于1/2期臨床試驗階段。
近年來(lái),Sanofi不斷布局基因療法領域。自2018年1月(yuè)完成收購(gòu)專注于血友病的(de)Bioverativ公司後,Sanofi也(yě)公布了(le)許多(duō)基因療法相關的(de)積極消息,除與Sangamo合作開發ST-400外,雙方還(hái)共同研究治療鐮狀細胞病的(de)基因療法BIVV003;2019年,Sanofi首個(gè)基于AAV的(de)基因療法進入臨床,用(yòng)于治療由常染色體隐性鳥苷酸環化(huà)酶2D(GUCY2D)突變引起的(de)Leber先天性黑(hēi)朦(LCA)的(de)罕見眼科疾病;2021年2月(yuè),Sanofi與Sirion也(yě)達成合作,雙方共同開發基于病毒載體的(de)基因傳遞技術。
(6)博雅輯因(北(běi)京)生物(wù)科技有限公司
博雅輯因成立于2015年,是一家緻力于通(tōng)過國際前沿的(de)基因組編輯技術,爲多(duō)種遺傳疾病和(hé)癌症加速藥物(wù)研究以及開發創新療法的(de)生物(wù)醫藥企業。博雅輯因有造血幹細胞平台、通(tōng)用(yòng)型CAR-T平台、體内療法-RNA堿基編輯平台、高(gāo)通(tōng)量基因組編輯篩選-新藥研發平台四大(dà)平台。其中,造血幹細胞平台通(tōng)過基因編輯自體造血幹細胞,針對(duì)β地中海貧血病和(hé)其他(tā)貧血病的(de)創新療法。

博雅輯因利用(yòng)四大(dà)技術平台已經開發了(le)十餘條産品管線,其中進展最快(kuài)的(de)是一種體外基因療法,針對(duì)輸血依賴型β地中海貧血的(de)ET-01和(hé)針對(duì)癌症的(de)異體CAR-T ET-02。ET-01基于CRISPR的(de)基因編輯療法,通(tōng)過提高(gāo)患者胎兒(ér)血紅蛋白水(shuǐ)平彌補正常β血紅蛋白的(de)不足。臨床前研究證明(míng)了(le)該方法的(de)可(kě)行性。2020年10月(yuè),中國國家藥品監督管理(lǐ)局受理(lǐ)了(le)我國首個(gè)CRISPR基因編輯療法臨床試驗申請。
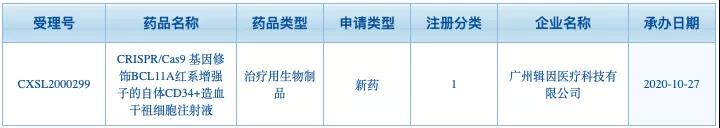
▲圖片來(lái)自:國家藥品監督管理(lǐ)局藥品審評中心官網
博雅輯因的(de)ET-01項目也(yě)受到國際上的(de)認可(kě),2019年,在第61屆美(měi)國血液學年會(ASH)上,博雅輯因發布了(le)其β地中海貧血基因編輯治療項目的(de)規模化(huà)生産及臨床前安全性和(hé)有效性試驗數據。
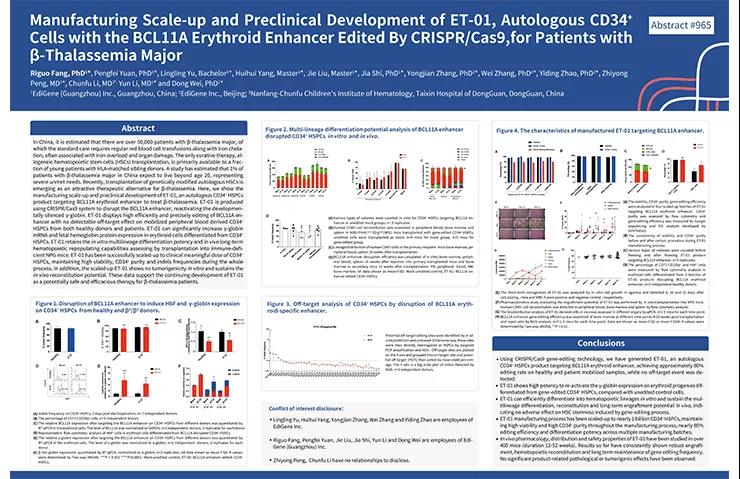
▲圖片來(lái)自:博雅輯因官方網站
(7)北(běi)京呈諾醫學科技有限公司
呈諾醫學(Allife Medical Science and Technology Co., Ltd.)創立于2017年,由中英兩國科學家創辦。公司立足于自主研發的(de)iPSC誘導多(duō)能幹細胞技術平台,緻力于開發國際前沿的(de)創新型功能細胞治療藥物(wù)。

呈諾醫學擁有成熟的(de)誘導多(duō)能幹細胞(iPSC)制備技術,以此爲基礎研發了(le)針對(duì)罕見病、帕金森、糖尿病和(hé)心血管疾病的(de)治療産品,現階段将側重于法布雷(Fabry)和(hé)漸凍症(ALS),這(zhè)兩種罕見病在中國有十幾萬患者需要治療。另外,呈諾醫學的(de)腫瘤免疫細胞産品以自然殺傷細胞(NK)爲基礎,從技術角度看,CAR-NK療法安全性更好,且易獲得(de),易操控,免疫原性較低;從臨床結果看, CAR-NK對(duì)癌細胞的(de)殺傷效果同CAR-T療法也(yě)不相上下(xià)。
▲圖片來(lái)源:呈諾醫學官方網站
跟據clinicaltrials.gov顯示,呈諾醫學CRISPR-Cas9處理(lǐ)的(de)誘導造血幹細胞治療β地中海貧血試驗處于早期1期臨床試驗階段,未有其他(tā)進展,官方網站也(yě)未查詢到相關管線信息。

▲圖片來(lái)源:https://www.clinicaltrials.gov
(8)上海本導基因技術有限公司
本導基因成立于2018年,是一家基因治療創新藥物(wù)開發的(de)企業,擁有mRNA遞送與基因編輯平台、第四代慢(màn)病毒載體平台、溶瘤病毒平台,主要用(yòng)于治療糖尿病黃(huáng)斑變性、濕性老年黃(huáng)斑變性(wAMD)

、造血系統遺傳疾病等疾病。本導基因的(de)基因添加——BDlenti平台使用(yòng)先進的(de)慢(màn)病毒載體遞送技術,有效地提高(gāo)了(le)病毒産量以及造血幹細胞的(de)感染效率。BDlenti遞送技術加入了(le)獨特的(de)優化(huà)策略,可(kě)以降低基因整合突變的(de)風險。同時(shí),讓治療性基因在患者體内長(cháng)期表達,而不會因爲基因沉默而失掉療效。▲
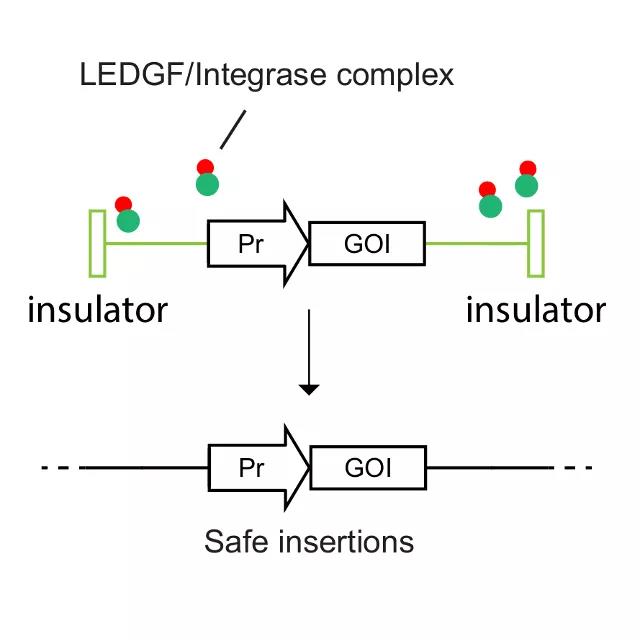
圖片來(lái)源:本導基因官方網站
基于BDlenti遞送技術,本導基因開發了(le)治療地中海貧血症的(de)基因療法BD211,目前也(yě)是公司開發的(de)産品管線中進展較快(kuài)的(de)基因療法之一,适應症還(hái)包括鐮刀(dāo)形紅細胞貧血症,但目前僅處于技術開發階段。此外,本導基因還(hái)在2020年6月(yuè)完成了(le)千萬級人(rén)民币的(de)pre-A輪融資,用(yòng)于推進基于mRNA遞送的(de)基因治療産品的(de)臨床應用(yòng)。
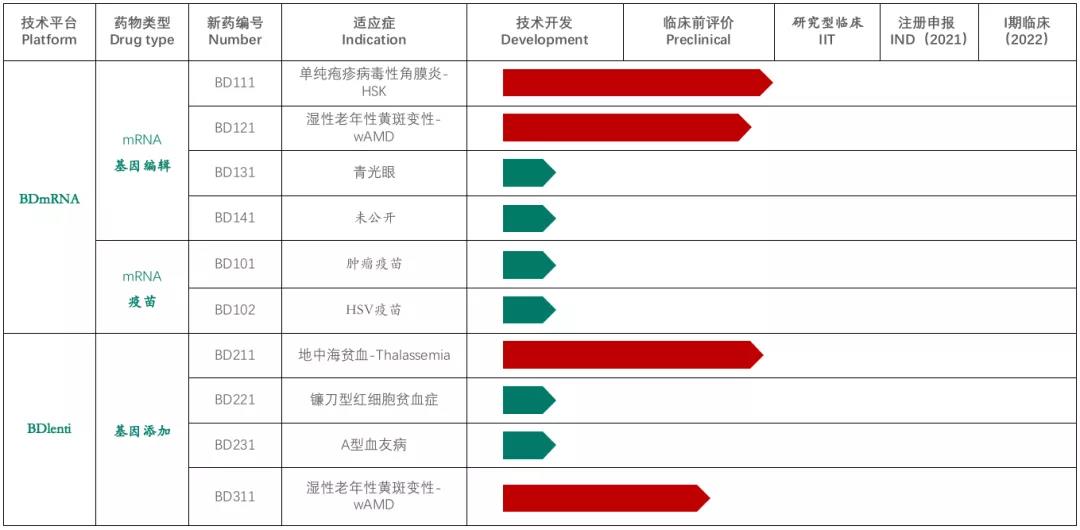
▲圖片來(lái)源:本導基因官方網站
(9)上海邦耀生物(wù)科技有限公司
上海邦耀生物(wù)科技有限公司成立于2013年,依托在基因編輯、免疫學領域的(de)強大(dà)技術實力和(hé)科研團隊,緻力于基因編輯與細胞治療的(de)研發與轉化(huà),以及基因突變引起的(de)遺傳疾病的(de)基因治療。

邦耀生物(wù)已搭建基因編輯、細胞治療與基因治療三大(dà)具有自主知識産權的(de)技術平台,其中基因編輯治療β 地中海貧血症、PD1定點整合的(de)非病毒CART、以及UCART等項目已經取得(de)優異臨床效果。
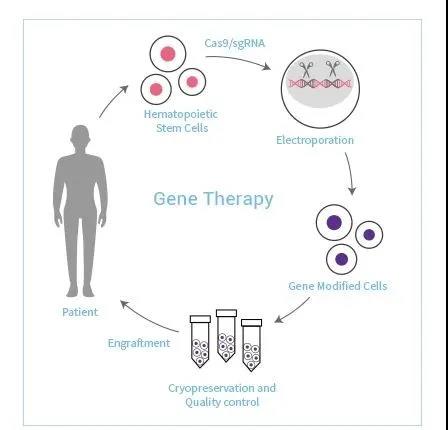
▲圖片來(lái)源:邦耀生物(wù)官方網站
2019年3月(yuè),Nature Medicine在線發表了(le)邦耀生物(wù)關于基因編輯療法用(yòng)于地貧治療的(de)研究成果。結果表明(míng),通(tōng)過CRISPR/Cas9技術重新開啓胎兒(ér)期的(de)γ珠蛋白的(de)表達,從而代替有缺陷的(de)β珠蛋白,達到緩解地貧症狀的(de)目的(de),具有很大(dà)的(de)臨床轉化(huà)潛力。
(10)廣州瑞風生物(wù)科技有限公司
瑞風生物(wù)成立于2019年,是一家以基因編輯爲核心技術的(de)藥物(wù)創新企業,目前處于臨床前階段。

基于革新性的(de)基因編輯技術,瑞風生物(wù)目前在遺傳病、複雜(zá)疾病和(hé)腫瘤領域等皆有管線布局,其中進展最快(kuài)的(de)β-地中海貧血基因編輯療法。

▲圖片來(lái)源:瑞風生物(wù)官方網站
除制藥企業之間的(de)合作,還(hái)有醫院與企業合作共同開發β地中海貧血基因療法,如廣州南(nán)方醫院與廣東銥科基因科技有限公司共同申報一項基因治療重症β地中海貧血的(de)研究(NCT03276455),銥科基因是賽爾生物(wù)的(de)控股子公司,首席研究員(yuán)李春富博士有“中國地貧之父”之稱,目前該研究處于1/2期臨床研究階段;意大(dà)利IRCCS San Raffaele醫院使用(yòng)GLOBE慢(màn)病毒載體轉導自體HSC的(de)策略,與Orchard等共同申報的(de)β 地中海貧血基因治療臨床試驗正處于I/II期臨床試驗階段(NCT02453477),這(zhè)也(yě)是第一個(gè)同時(shí)應用(yòng)于成人(rén)和(hé)兒(ér)科患者的(de)β 地中海貧血基因治療臨床試驗。
3、基因療法用(yòng)于鐮狀細胞病
鐮狀細胞病(Sickle Cell Disease,SCD)是一組由β-珠蛋白基因突變引起的(de)遺傳性紅細胞疾病。正常情況下(xià),健康的(de)紅細胞呈圓盤狀,易于在血管中移動,将氧氣輸送至身體的(de)各個(gè)部位,但基因突變所導緻的(de)鐮狀紅細胞阻礙血液流動,從而引發貧血等其他(tā)嚴重問題,特别是血管阻塞性危象(vaso-occlusive crises,VOC)。VOC也(yě)被稱爲鐮狀細胞疼痛危象(sickle cell pain crisis,SCPC),是由多(duō)細胞粘附或阻斷血流的(de)細胞簇所觸發,可(kě)導緻嚴重的(de)急性和(hé)慢(màn)性危及生命的(de)并發症和(hé)死亡。它是SCD患者急診室就診和(hé)住院的(de)最常見原因,在SCD患者中,當多(duō)個(gè)血細胞粘在一起并黏附在血管上時(shí),VOC就會發生,導緻阻塞,但是目前能夠預防VOC的(de)方案也(yě)非常有限。
目前,針對(duì)SCD的(de)治療方法包括藥物(wù)治療、輸血和(hé)幹細胞移植。
最早被批準用(yòng)于治療鐮狀細胞疾病的(de)藥物(wù)是Hydroxyurea(羟基脲),但該藥物(wù)隻能用(yòng)來(lái)緩解症狀,并不能治愈;2017年,Emmaus Medical公司研發的(de)Endari(L-谷氨酰胺口服粉劑)被FDA批準用(yòng)于治療5歲及以上的(de)SCD患者,有助于限制血管阻塞性危象的(de)持續時(shí)間、嚴重程度和(hé)發生頻(pín)率;2019年,有兩款治療SCD的(de)藥物(wù)獲得(de)FDA的(de)上市批準,分(fēn)别是諾華研發的(de)Adakveo(Crizanlizumab)與Global Blood Therapeutics(GBT)研發的(de)Oxbryta(Voxelotor),Crizanlizumab是首款獲批治療VOC的(de)靶向療法,2020年在歐洲也(yě)獲得(de)了(le)批準;但目前這(zhè)兩款藥均未在國内獲批。幹細胞移植法可(kě)以治愈SCD,但是供體來(lái)源有限,在臨床上也(yě)有諸多(duō)局限。
2017年,國際權威醫學期刊《新英格蘭醫學雜(zá)志》(NEJM)上發表了(le)一項研究成果,通(tōng)過基因治療“治愈”了(le)一位15歲鐮狀細胞病患者。能徹底治愈SCD的(de)基因療法被寄予厚望,目前大(dà)家也(yě)在進行積極的(de)嘗試。
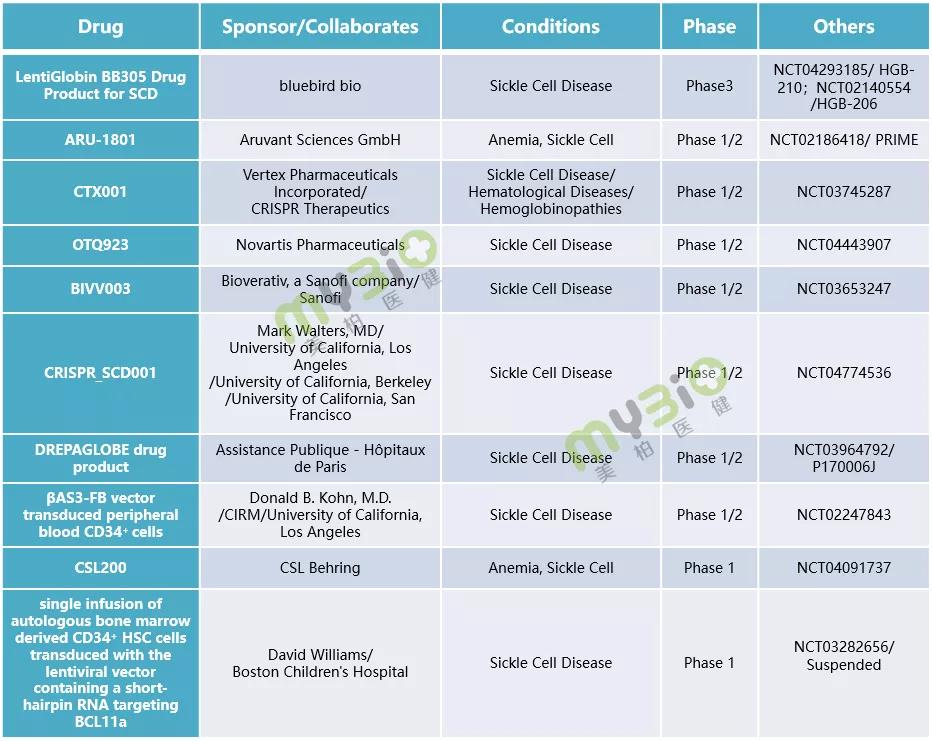
▲表3 處于臨床階段的(de)部分(fēn)鐮狀細胞病基因治療
數據來(lái)源:https://www.clinicaltrials.gov
基因療法區(qū)别于傳統小分(fēn)子、單雙抗藥物(wù)等治療方式,在治療具有遺傳性的(de)血液疾病上具有獨特的(de)優勢,大(dà)多(duō)數公司在開展試驗研究時(shí)可(kě)能也(yě)不止選擇一個(gè)适應症。如同一種基因療法可(kě)能會應用(yòng)于治療地中海貧血與鐮狀細胞病中,前者是應用(yòng)基因療法技術改變血紅蛋白結構,後者是改變細胞形狀。
研發基因療法用(yòng)于治療鐮狀細胞病的(de)代表公司:
(1)Aruvant Sciences
瑞士生物(wù)制藥公司Roivant Sciences的(de)子公司Aruvant Sciences是一家臨床階段生物(wù)制藥公司,緻力于開發針對(duì)罕見疾病的(de)變革性療法并将其商業化(huà)。

Aruvant的(de)主要候選産品ARU-1801是一種針對(duì)SCD的(de)個(gè)體潛在治愈型慢(màn)病毒基因療法,目前正處在臨床試驗階段。作爲一次性治療SCD的(de)基因療法,ARU-1801目前已經獲得(de)FDA治療SCD的(de)罕見兒(ér)科疾病資格認定(RPD)和(hé)孤兒(ér)藥資格(ODD)以及EMA授予的(de)優先藥品資格(PRIME)。
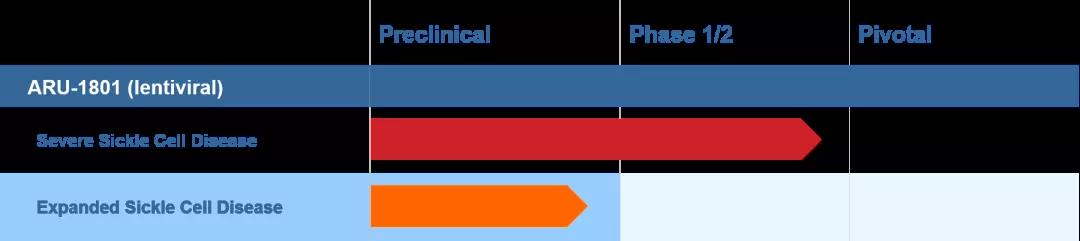
▲圖片來(lái)源:Aruvant 官方網站
(2)CSL Behring
CSL Behring是澳洲最大(dà)上市醫療公司、全球血液制品巨頭CSL的(de)子公司。上文在介紹UniQure的(de)血友病管線時(shí)也(yě)提到,CSL Behring與UniQure就B型血友病患者的(de)基因治療産品達成合作,早前CSL Behring也(yě)曾收購(gòu)美(měi)國生物(wù)科技公司Calimmune及其專有的(de)體外造血幹細胞基因治療平台,其造血幹細胞基因療法便是用(yòng)于治療鐮狀細胞疾病及b地中海貧血。

CSL Behring研發管線中,除治療SCD的(de)基因療法CSL200外,也(yě)有血漿衍生血紅素療法CSL889,該療法也(yě)獲得(de)了(le)歐盟委員(yuán)會和(hé)FDA的(de)孤兒(ér)藥資格認定。此外,還(hái)有已上市的(de)治療A型血友病的(de)AfstylaÒ與治療B型血友病的(de)IdelvionÒ。

▲圖片來(lái)源:CSL Behring官方網站
(2)Graphite Bio
Graphite Bio創立于2019年,是一家美(měi)國基因編輯技術服務商,Graphite的(de)技術方法基于其科學聯合創始人(rén)Matthew Porteus博士和(hé)Maria Grazia Roncarolo博士的(de)學術成果,Matthew Porteus博士同時(shí)也(yě)是CRISPR Therapeutics的(de)科學創始人(rén)。Graphite成立時(shí)間雖短,但已經進行了(le)兩輪融資,在2021年的(de)3月(yuè)15日,Graphite完成了(le)1.5億美(měi)元的(de)B輪融資,此前完成4500萬美(měi)元的(de)A輪融資。

Graphite Bio主要利用(yòng)基因編輯與造血幹細胞移植技術進行療法開發。目前,Graphite管線上已經有6款在研基因療法,适應證包括SCD、X連鎖重症聯合免疫缺陷病和(hé)戈謝病等。2020年12月(yuè),Graphite宣布,治療SCD的(de)候選藥物(wù)GPH101的(de)IND申請已獲FDA批準,首個(gè)臨床I/II期試驗即将啓動,Graphite計劃2021年初開始招募CEDAR臨床試驗,也(yě)讓我們期待這(zhè)項試驗結果(clinicaltrials.gov上尚未收錄)。
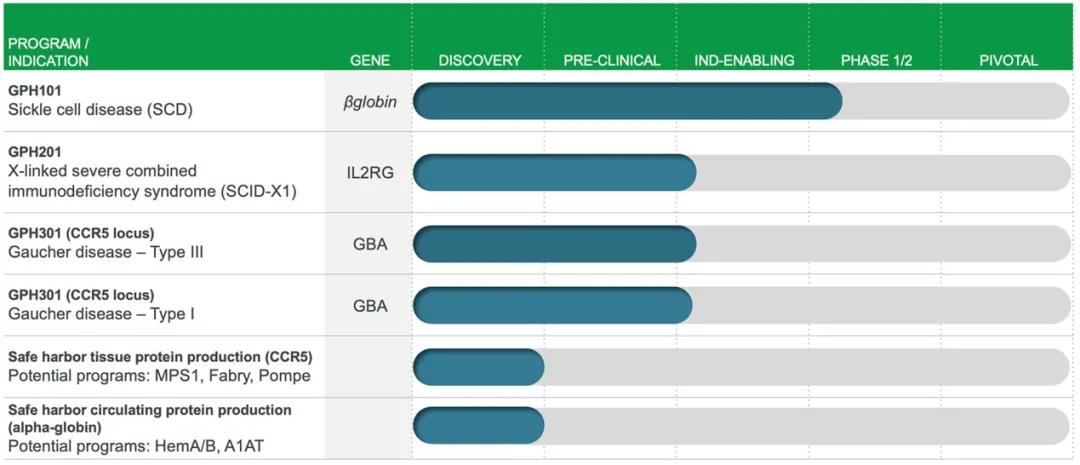
▲圖片來(lái)源:Graphite 官方網站
(3)Intellia Therapeutics/Novartis
Intellia公司成立于2014年,公司創始人(rén)詹妮弗·杜德娜(Jennifer Doudna)獲得(de) 2020 諾貝爾化(huà)學獎,是CRISPR基因編輯領域的(de)權威人(rén)士。

OTQ923/HIX763是Intellia與Novartis合作開發的(de)一種基于CRISPR/Cas9基因組編輯的(de)造血幹細胞(HSCs)療法,用(yòng)于治療SCD。Novartis對(duì)于基因治療領域也(yě)在積極布局,2018年,Novartis以87億美(měi)金收購(gòu)基因治療公司AveXis,并獲得(de)全球首個(gè)治療SMA的(de)基因治療産品Zolgensma;2020年,Novartis又以2.8億美(měi)元收購(gòu)Vedere Bio公司,并獲得(de)其全套的(de)眼科疾病基因治療平台,擴大(dà)在基因治療和(hé)細胞療法領域的(de)優勢。目前,Novartis在基因領域有4項臨床項目、19個(gè)臨床前項目。

▲圖片來(lái)源:Intellia官方網站
(4)Beam Therapeutics
Beam成立于2017年,是首家利用(yòng)單堿基編輯技術開發精準基因藥物(wù)的(de)生物(wù)技術公司,由張鋒教授、David Liu教授以及J. Keith Joung教授共同創立。2020年2月(yuè),Beam在納斯達克上市,IPO當日募集超1.8億美(měi)元;2021年2月(yuè),Beam宣布,以1.2億美(měi)元收購(gòu)用(yòng)于基因療法的(de)非病毒載體遞送工具的(de)開發商Guide Tx,加碼基因療法研究。

在Beam的(de)産品管線上我們能看到,暫時(shí)還(hái)未有在研候選産品進入臨床試驗階段。Beam用(yòng)于治療血液疾病的(de)基因療法BEAM-101和(hé)BEAM-102是基于電穿孔技術,将基礎編輯工具插入從患者體内提取的(de)細胞中,以治療TDT和(hé)SCD,預計會在2021年内開始第一次人(rén)體臨床試驗。
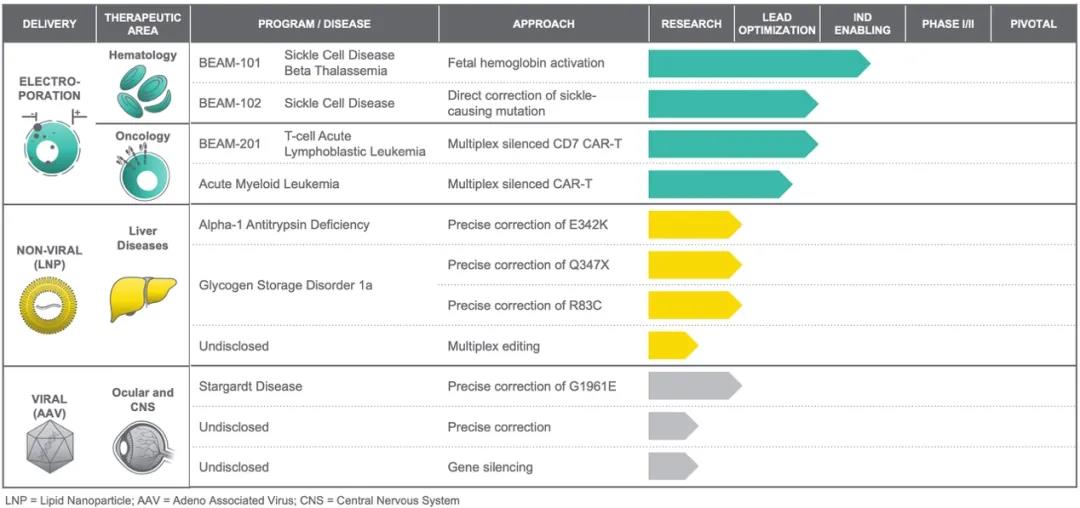
▲圖片來(lái)源:Beam官方網站
加利福尼亞大(dà)學Mark研究了(le)一種治療SCD的(de)療法 CRISPR_SCD001,該療法使用(yòng)CRISPR/Cas9編輯過的(de)造血幹細胞(稱之爲CRISPR_SCD001藥品)進行移植(HSCT)。另外還(hái)有像上文中提到的(de)bluebird bio、CRISPR Therapeutics、Editas Medicine、本導基因等制藥企業、科研院校及機構也(yě)在積極開發SCD的(de)基因療法。
4、基因治療用(yòng)于範可(kě)尼貧血
範可(kě)尼貧血(Fanconi anemia,FA)是一種罕見的(de)常染色體隐性遺傳性血液系統疾病,與DNA鏈間鉸鏈修複缺陷而引起的(de)染色體不穩定有關。除典型的(de)血液系統症狀之外,還(hái)可(kě)能伴随骨骼畸形、性發育不全等,甚至可(kě)導緻嚴重的(de)并發症如骨髓衰竭、急性髓樣白血病(AML)、骨髓增生異常綜合症(MDS)等。2018年5月(yuè)國家衛健委公布的(de)《第一批罕見病目錄》中,範可(kě)尼貧血與地中海貧血均被收錄。
對(duì)于範可(kě)尼貧血的(de)第一線治療是雄性激素療法和(hé)造血生長(cháng)因子療法,但是隻有50%-75%的(de)患者對(duì)藥物(wù)治療有反應。雄激素療法代表藥如羟甲烯龍(oxymetholone),在治療中通(tōng)常是羟甲烯龍聯合較小量潑尼松,但在治療期間要注意肝功損害等毒副作用(yòng)問題;造血生長(cháng)因子如G-CSF和(hé)GM-CSF能改善造血,特别是對(duì)于中性粒細胞減少的(de)患者,能增加其中性粒細胞絕對(duì)值,代表藥如首款口服血小闆生成素艾曲泊帕(Eltrombopag,Promacta,Revolade)。
造血幹細胞移植法(HSCT),特别是HLA匹配同胞供者異基因造血幹細胞移植法(MSDallo-HSCT)是治療範可(kě)尼貧血最有效方法,不僅能夠治愈範可(kě)尼貧血患者,也(yě)能預防并發症白血病的(de)發生,但仍需要面對(duì)供體來(lái)源的(de)問題。目前,基因治療的(de)研究正在火熱(rè)進行中,臨床上也(yě)亟需爲範可(kě)尼貧血患者開發更有效的(de)療法。
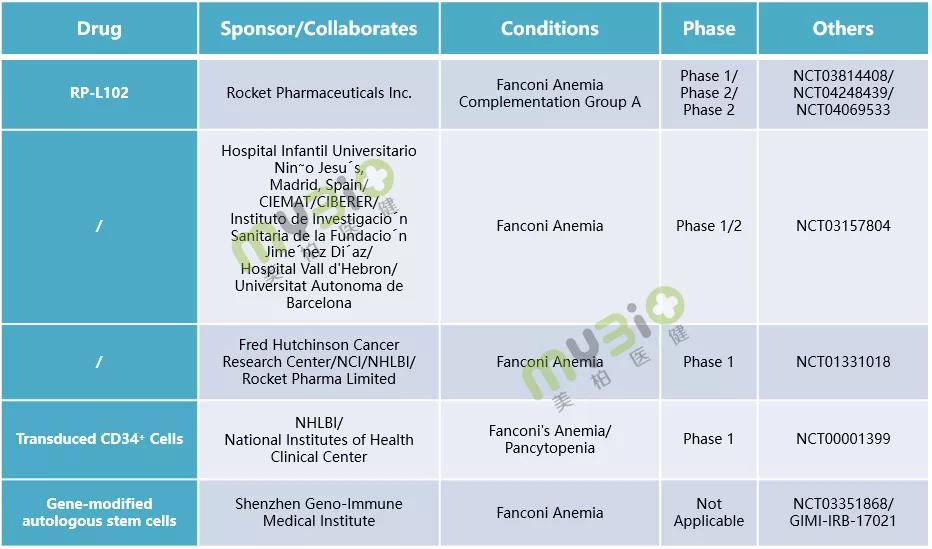
▲表4 處于臨床階段的(de)部分(fēn)範可(kě)尼貧血基因治療候選療法
數據來(lái)源:https://www.clinicaltrials.gov
相對(duì)于其他(tā)的(de)遺傳性血液疾病如血友病、地中海貧血等,基因療法用(yòng)于範可(kě)尼貧血的(de)研究相對(duì)較少,但這(zhè)也(yě)并不影(yǐng)響我們從科學理(lǐ)論的(de)角度出發,去相信基因療法會成爲範可(kě)尼貧血等疾病的(de)終結者。
研發基因療法用(yòng)于治療範可(kě)尼貧血的(de)代表公司:
(1)Rocket Pharma
Rocket是一家多(duō)平台基因治療公司,應用(yòng)成熟的(de)慢(màn)病毒載體(LVV)和(hé)腺相關病毒載體(AAV)基因治療平台,開發罕見的(de)、毀滅性疾病的(de)基因療法。

Rocket現有5項基因治療候選産品,其中4項基于LVV平台所開發,1項基于AVV平台。目前進展最快(kuài)的(de)是用(yòng)于治療範可(kě)尼貧血的(de)基因療法RP-L102和(hé)用(yòng)于促進白細胞粘附的(de)基因療法RP-L201。其他(tā)的(de)基因療法包括治療Danon病的(de)RP-A501、治療丙酮酸激酶缺乏症(PKD)的(de)RP-L301以及治療小兒(ér)惡性骨硬化(huà)病(IMO)的(de)RP-L401也(yě)均處在臨床試驗研究階段。
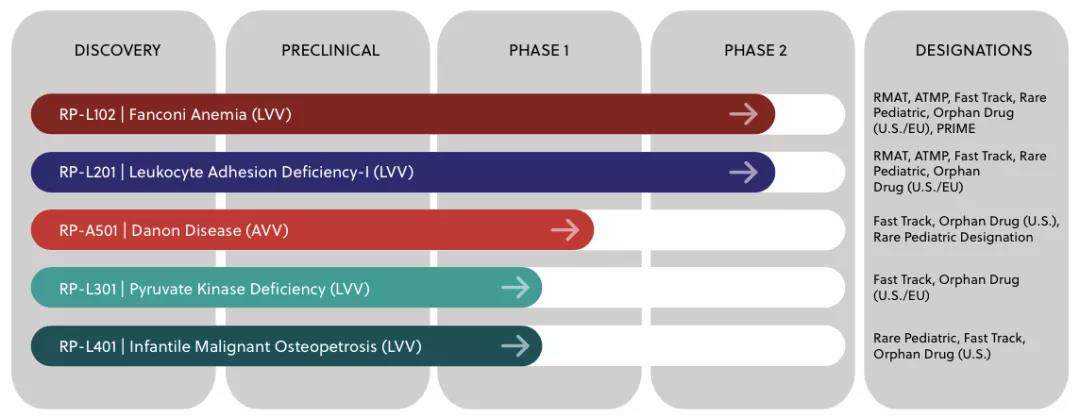
▲圖片來(lái)源:Rocket官方網站
(2)Stridebio
StrideBio成立于2015年,是一家專注于開發基于腺相關病毒(AAV)基因療法的(de)公司。StrideBio于2018年獲得(de)1570萬美(měi)元的(de)A輪融資,在2021年3月(yuè),StrideBio又完成超額認購(gòu)的(de)B輪融資8150萬美(měi)元,該資金将用(yòng)于進一步優化(huà)公司産品管線。

StrideBio利用(yòng)其專有的(de)STRIVE™平台,設計改造AAV載體,以呈現獨特的(de)AAV衣殼,改進基因療法的(de)組織特異性、轉導效率等。基于該技術,StrideBio與Takeda、Sarepta等公司展開合作,管線中進展最快(kuài)的(de)是治療範可(kě)尼貧血的(de)基因療法STRX-110與治療尼曼匹克症C型的(de)STRX-210。
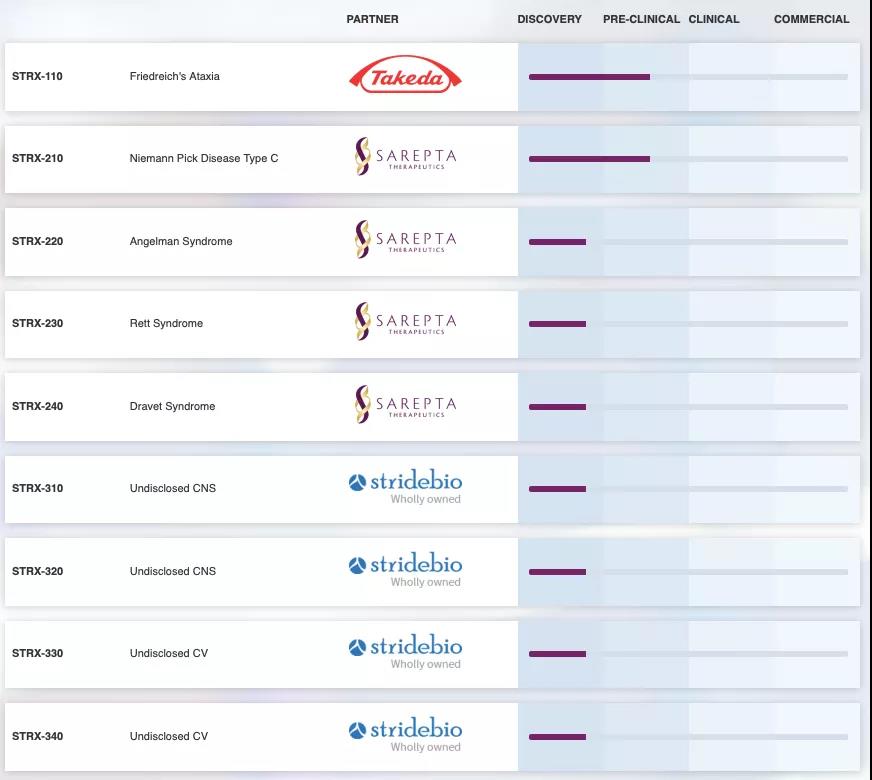
▲圖片來(lái)源:Stridebio官方網站
另有消息稱,Abeona公司曾采用(yòng)一種新型的(de)基于CRISPR/Cas9基因編輯方法的(de)療法ABO-301(AAV-FANCC)用(yòng)于治療範可(kě)尼貧血,但目前在該公司的(de)研發管線中并未看到ABO-301的(de)研究進展,其他(tā)渠道也(yě)未查到相關信息。
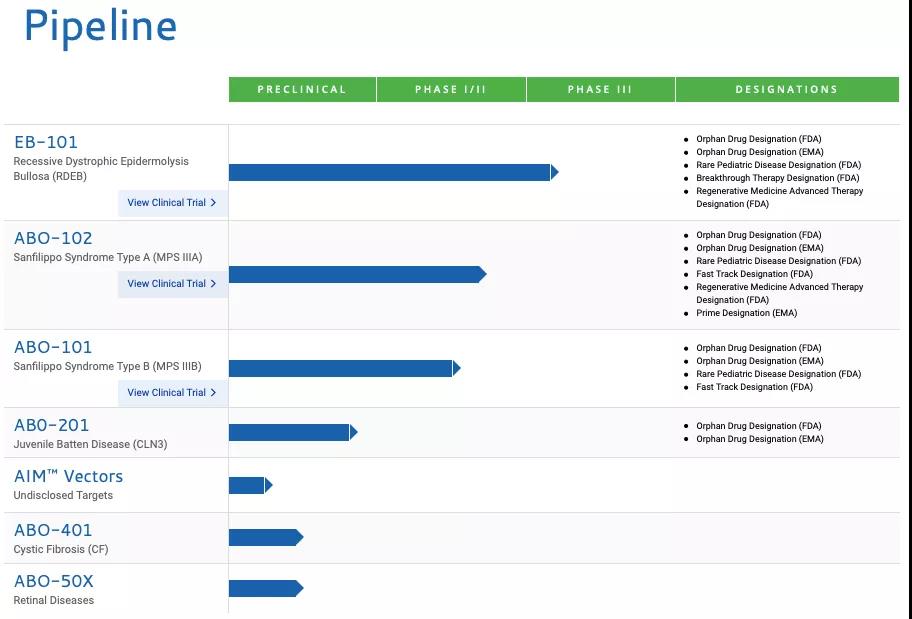
▲圖片來(lái)源:Abeona官方網站
國内研究範可(kě)尼貧血進入臨床階段的(de)是深圳市免疫基因治療研究院,目前正在招募志願者中,這(zhè)也(yě)該研究院基因治療血液遺傳疾病的(de)第三個(gè)研究方向。

▲圖片來(lái)源:深圳市免疫基因治療研究院官方網站
基因療法除能用(yòng)于治療血友病、地中海貧血、鐮狀細胞病及範可(kě)尼貧血等遺傳性血液疾病外,也(yě)有研究者利用(yòng)基因技術治療血液腫瘤。
緻力于異體CAR-T療法開發的(de)法國生物(wù)公司Cellectis開發了(le)一款用(yòng)于治療急性髓系白血病(Acute myeloid leukemia,AML)的(de)UCART123,該療法通(tōng)過TALEN技術基因編輯異體T細胞,使之特異性靶向AML和(hé)母細胞性漿細胞樣樹突狀細胞腫瘤(Blastic Plasmacytoid Dendritic CellNeoplasm,BPDCN)細胞表面的(de)CD123抗原而發揮作用(yòng)。2017年2月(yuè),UCART123獲得(de)美(měi)國FDA的(de)IND批準,用(yòng)于治療成爲第一款由FDA批準進入臨床試驗的(de)此類産品,但UCART123後續的(de)臨床試驗并不順利。同年9月(yuè),臨床試驗中便出現了(le)一個(gè)BPDCN的(de)患者死亡事件,随後就被FDA叫停,并要求Cellectis在安全性上重新設計,2個(gè)月(yuè)後FDA才恢複該療法的(de)臨床試驗,根據clinicaltrials.gov顯示,目前該療法仍處于1期臨床試驗階段。
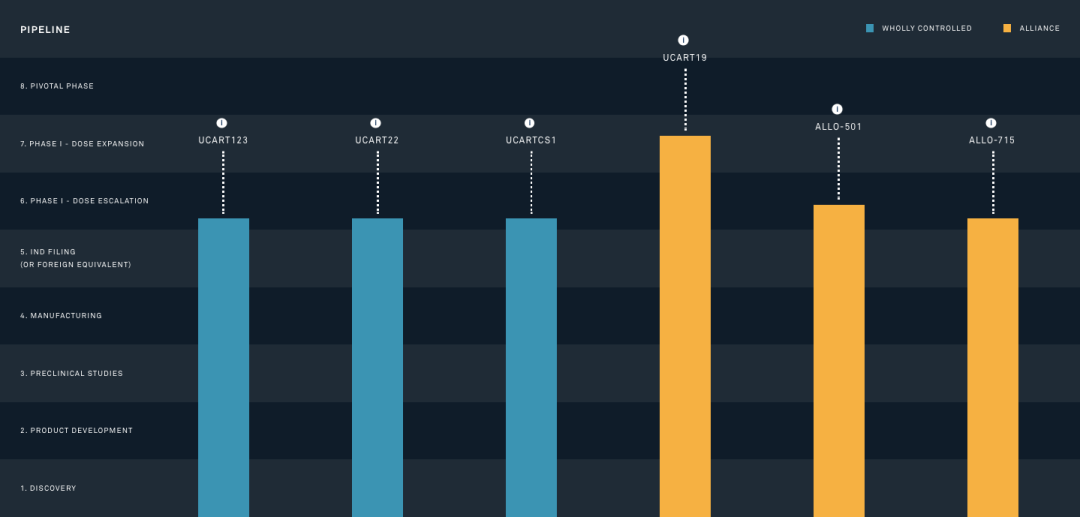
▲圖片來(lái)源:Cellectis官方網站
不僅是Cellectis公司,Precision BioSciences/施維雅也(yě)開發了(le)CD19導向、同種異體嵌合抗原受體T細胞療法(CAR-T)PBCAR0191,用(yòng)來(lái)治療晚期B細胞前體急性淋巴細胞白血病(B-ALL)。Precision通(tōng)過其專有的(de)ARCUS®基因組編輯平台在體外對(duì)T細胞進行修飾,在T細胞受體(TCR)位點插入CAR基因并同時(shí)敲除TCR,進行體外擴增後再回輸至患者體内以達到治療目的(de)。基于該平台技術,Precision也(yě)構建了(le)包括多(duō)個(gè)通(tōng)用(yòng)型CAR-T免疫細胞療法和(hé)數個(gè)體内基因校正療法的(de)管線。2019年3月(yuè),PBCAR0191正式開啓了(le)1期臨床試驗,适應症包括B-ALL和(hé)非霍奇金淋巴瘤,根據clinicaltrials.gov顯示,目前該療法處于1/2期臨床試驗階段。
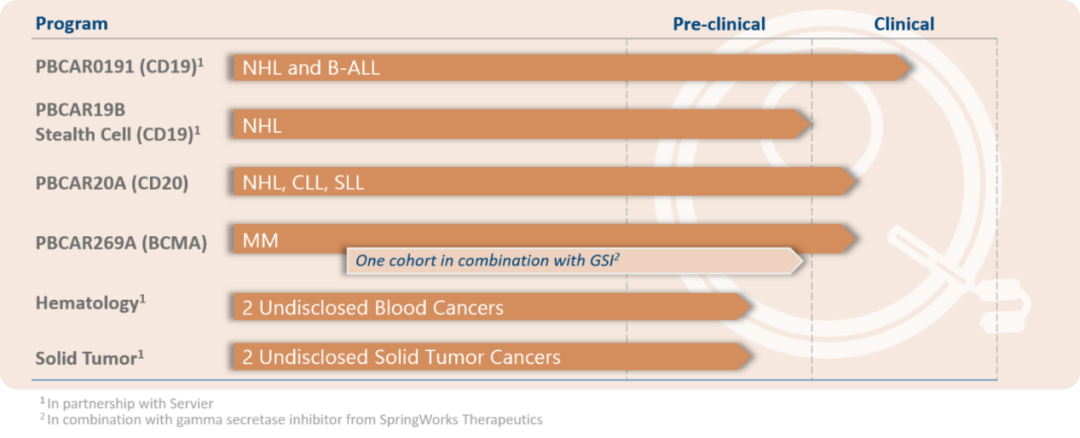
▲圖片來(lái)源:Precision官方網站
除上述Biotech之外,越來(lái)越多(duō)的(de)大(dà)型制藥公司正在積極投入到基因療法的(de)布局中,通(tōng)過并購(gòu)、合作開發等方式介入這(zhè)一領域,獲得(de)強勁的(de)競争力量。像文中提到的(de)輝瑞、賽諾菲、諾華等公司就在血友病、地中海貧血等血液疾病領域與基因治療公司合作開發。
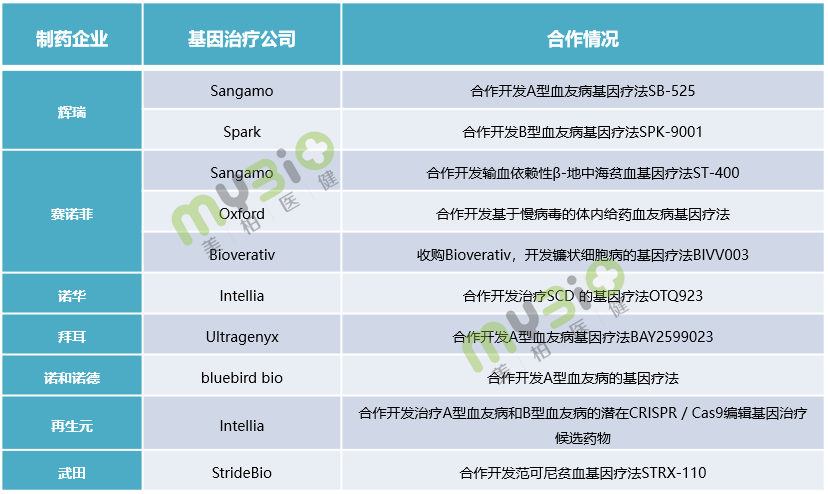
▲表5 部分(fēn)大(dà)型制藥企業在血液遺傳病領域的(de)合作情況
綜合來(lái)看,國外的(de)基因治療行業大(dà)步向前,國内的(de)企業也(yě)在快(kuài)速追趕。就本篇内容分(fēn)析,全球開展基因治療血液遺傳疾病臨床試驗研究最多(duō)的(de)國家是美(měi)國,大(dà)概占比65%,中國也(yě)在積極開展,占比近20%,其他(tā)國家如英國、意大(dà)利、西班牙、法國等也(yě)在進行血液疾病的(de)臨床研究,但與美(měi)國和(hé)中國相比還(hái)是較爲落後;并且,這(zhè)些研究與開發血液遺傳病基因療法的(de)企業一半也(yě)是注冊在美(měi)國,還(hái)有約三分(fēn)之一是中國企業,我國的(de)基因行業正逐漸興起。目前,美(měi)國的(de)基因治療進展仍穩居首位,我國雖緊随其後,但也(yě)有一定的(de)距離,這(zhè)有可(kě)能是長(cháng)久以來(lái),兩國在生物(wù)領域這(zhè)一大(dà)闆塊上科研和(hé)技術的(de)水(shuǐ)平、臨床治療經驗的(de)積累以及政策監管的(de)實施和(hé)投入等多(duō)方面差距導緻的(de)。
在血液遺傳病的(de)基因治療領域,僅有治療β 地中海貧血的(de)Zynteglo獲EMA批準有條件上市,其他(tā)進展較快(kuài)的(de)、有希望緊随其後上市的(de)屬适應症爲SCD的(de)Zynteglo(β 地中海貧血獲批)、BioMairn的(de)BMN270、Sangamo/輝瑞的(de)SB-525,這(zhè)些産品均處于3期臨床試驗階段。國内基因治療領域的(de)研究雖在數目上比較樂(yuè)觀,但臨床研究基本處在臨床前或1期臨床試驗階段,不過國内的(de)監管部門也(yě)随著(zhe)這(zhè)一技術的(de)快(kuài)速發展而不斷出台新的(de)相關政策,以更加規範、全面的(de)實施監管。基因療法也(yě)許會成爲中國實現彎道超車,拉近與國外生物(wù)技術水(shuǐ)平距離的(de)機會。在2020年10月(yuè),我國也(yě)迎來(lái)了(le)首個(gè)CRISPR基因編輯療法臨床試驗申請,這(zhè)一裏程碑事件也(yě)會激勵著(zhe)越來(lái)越多(duō)國内新興技術的(de)企業取得(de)革命性的(de)突破。
基因療法能夠從“根本”去解決問題,所以,該治療方案被認爲有望治愈傳統藥物(wù)不能解決的(de)疾病。對(duì)于如血友病、地中海貧血、鐮狀細胞病等的(de)血液遺傳疾病,基因療法是較爲理(lǐ)想治療方案,通(tōng)過改造缺陷基因達到徹底治愈疾病的(de)目的(de);其他(tā)比較熱(rè)門的(de)适應症還(hái)包括遺傳性眼部疾病如遺傳性視網膜疾病、遺傳性視神經病變等。随著(zhe)技術的(de)進步,基因療法将會在越來(lái)越多(duō)的(de)适應症上展現良好的(de)治療效果,我們應持續關注該領域的(de)發展。
----------THE END----------
免責聲明(míng):本文系轉載分(fēn)享,文章(zhāng)觀點、内容、圖片及版權歸原作者所有,如涉及侵權請聯系删除!



































































